В основу принятой классификации положен тип катализируемой реакции (специфичность действия), который является специфичным для действия любого фермента. Этот принцип используется в качестве основы для классификации и номенклатуры ферментов. Таким образом, тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) (табл. 1).
Таблица 1. Международная классификация ферментов
| № | Класс | Тип катализируемой реакции |
| Оксидоредуктазы | Перенос электронов и протонов | |
| Трансферазы | Перенос любых групп атомов, отличных от атомов водорода | |
| Гидролазы | Гидролиз различных связей (с участием молекулы воды) | |
| Лиазы | Образование двойных связей за счет удаления групп или добавление групп за счет разрыва двойных связей | |
| Изомеразы | Внутримолекулярный перенос групп с образованием изомерных форм | |
| Лигазы (синтетазы) | Соединение двух молекул и образование связей С—С, С—О, С—S и С—N, сопряженных с разрывом пирофосфатной связи АТФ |
1. ОКСИДОРЕДУКТАЗЫ, класс ферментов, катализирующих обратимые окислительно-восстановительные реакции, в которых происходит перенос восстановительных эквивалентов (двух атомов Н, двух электронов или гидрид-иона Н-) от восстановителя (специфический субстрат реакции) к окислителю (относительно не-специфический субстрат).
Большинство реакций окисления в клетке протекает без участия кислорода, путем дегидрирования:
|
|
АН2 + В ↔ А + ВН;
где АН2 - восстановитель, В – окислитель
Ферменты класса оксидоредуктаз (О.), осуществляющие дегидрирование называются дегидрогеназы, и подразделяются на анаэробные и аэробные.
Анаэробные дегидрогеназы отщепляют протоны от субстрата, для которых акцептором служит не О2, а любое др. соединение (редуктазы), или передают их на промежуточные переносчики, которые сгружают их затем как правило в ЦПЭ, где происходит окислительное фосфорилирование, и генерируется энергия, которая запасается в виде универсального аккумулятора АТР. Все они относятся к сложным белкам, в качестве коэнзимов содержат NAD+, NADР+, FAD+, FMN+, и являются высокоспецифичными к субстрату ферментами:
Аэробные дегидрогеназы в качестве акцептора водорода используют молекулярный кислород с образованием перекиси водорода или воды Такие дегидрогеназы называются оксидазами:
В тех случаях, когда атом О включается в состав субстрата, ферменты называются оксигеназами (при включении в молекулу одного атома О монооксигеназами, двух атомов О-диоксигеназами), если атом О включается в виде группы ОН-гидроксилазами:
К О. относится большая группа ферментов (около 20% от общего их числа). Многие О. (около 170 ферментов) в качестве акцепторов используют никотинамидные коферменты -никотинамидадениндинуклеотид (NAD) и никотин-амидадениндинуклеотидфосфат (NADP). Эти дегидрогеназы (напр., альдегиддегидрогеназы, лактатдегидрогеназы) выполняют важные функции, участвуя в гликолизе, дыхании, брожении, а также на начальном этапе окислительного распада аминокислот при деградации белков. Некоторые дегидрогеназы аминокислот (напр., глутаматдегидрогеназа) могут катализировать синтез аминокислот, участвуя в ассимиляции NH3 микроорганизмами и растениями. Считается, что восстановительные эквиваленты от восстановленного NAD (т. е. от NADН) переносятся в клетке на О2 через дыхательную цепь переноса электронов (см. Окислительное фосфорилирование), где свободная энергия этих эквивалентов расходуется для запасания энергии в виде макроэргической связи АТР; восстановительные эквиваленты NADРН расходуются для биосинтетических целей.
|
|
Ряд дегидрогеназ в качестве акцептора содержит химически прочно связанный с ферментом флавинмононуклеотид или флавинадениндинуклеотид (соотв. FМN и FAD; см. Рибофлавин). В таких флавопротеидах FМN или FAD восстанавливаются в результате окисления NADН или NADРН, а затем передают восстановительные эквиваленты др. компонентам цепи переноса электронов при дыхании, напр. цитохромам или непосредственно на О2. Другой продукт реакций, катализируемых флавопротеидными О.,-Н2О2. Ферменты, использующие Н2О2 в качестве акцепторов восстановит. эквивалентов (напр., каталаза), называются пероксидазами. (См. также глутатионредуктаза, липоксигеназы, монофенол-монооксигеназы, нитратредуктазы, рибонуклеозиддифосфатредуктазы, сукцинатдегидрогеназы, супероксиддисмутазы, тетрагидрофолатдегидрогеназы, трансгидрогеназы, цитохром-с-оксидаза.)
2. ТРАНСФЕРАЗЫ(Т.), класс ферментов, катализирующих перенос фрагментов молекул (напр., метила, ацетила, гликозила) с одного соединения (донора) на другие соединения (акцептор). Во многих случаях промежуточным донором является кофермент, присоединяющий группу, подлежащую переносу.
|
|
Подклассы Т. (их 8) различают по характеру групп, переносимых на акцептор. К подклассу Т., катализирующих перенос одноуглеродных фрагментов, относятся метил-трансферазы, Т. гидроксиметильных, формальных и др. родственных групп, карбоксил- и карбамоилтрансферазы и др. Перенос группы СН3 осуществляется, напр., с 5-метил-тетрагидрофолиевой к-ты (см. Фолацин) на гомоцистеин HSCH2CH2CH(NH2) COOH на последней стадии биосинтеза метионина. Универсальный донор групп СН3 при трансметилировании - S-аденозилметионин - субстрат метил-трансфераз, модифицирующих нуклеиновые к-ты; эти ферменты играют важную роль в функционировании генетического аппарата клетки. Известны также Т., катализирующие метилирование жирных к-т, ненасыщ. фосфолипидов, полисахаридов и др. Многие Т., катализирующие перенос гидроксиметильных и формильных остатков (напр., серин-гидрокси-метилтрансфераза), содержат в качестве кофермента пиридоксальфосфат (см. Витамин В6).
В отдельный подкласс объединяют Т., катализирующие перенос альдегидных и кетонных групп (фрагментов молекул углеводов). В него входит, например, транскетолаза и трансальдолаза, переносящая фрагмент НОСН2С(О) в пентозофосфатном цикле.
Подкласс Т. составляют ацилтрансферазы, катализирующие перенос ацильной группы с образованием эфиров и амидов. Донором в этих реакциях обычно является ацилкофермент А (см. Пантотеновая кислота). Реакции, катализируемые этими Т., наиболее характерны для метаболизма жирных к-т. Акцепторами ацетила (донор Ас Со-А) могут быть аминокислоты, глюкозамин, остаток фосфорной к-ты и др.
Некоторые Т. этого подкласса при трансляции в качестве донора используют аминоацил-транспортную РНК. Пример Т. этого подкласса-фосфатацетилтрансфераза, катализирующая перенос ацетила на фосфорную к-ту с образованием ацетилфосфорной к-ты.
К отдельному подклассу относят Т., катализирующие перенос гликозильных остатков (гликозилтрансферазы). Некоторые из этих Т. обладают также гидролитической активностью, которая может рассматриваться как перенос гликозильного остатка на молекулу воды. Акцептором может служить также Н3РО4 в случае фосфорилаз. Наиболее распространен перенос остатка углевода от олигосахарида или богатого энергией метаболита на другую молекулу углевода. К наиболее изученным Т. этого подкласса можно отнести ферменты синтеза гликогена [например, гликоген(крахмал)синтазу и га-локтозилтрансферазу].
В отдельный подкласс объединяют Т., катализирующие перенос алкильных групп (отличающихся от СН3), как замещенных, так и не замещенных. Хорошо изученные Т. этого подкласса-глутатионтрансферазы, катализирующие перенос различных остатков на глутатион, а также метионин-аденозил- и енолпируват-трансфераза.
Отдельно рассматривают подкласс Т., катализирующих перенос групп, содержащих атом N. Т. этого подкласса ответственны за перенос аминогрупп. Аминотрансферазы катализируют перенос аминогруппы с аминокислот на 2-оксокислоты. Эта реакция является, по существу, окислительно-восстановительной. Однако из-за того, что основной функцией этих ферментов считается перенос групп NH2, они классифицируются как Т., а не как оксидоредуктазы. Наиболее изученные ферменты этого подкласса-аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ), содержащие в качестве кофермента пиридоксальфосфат.
Важный подкласс Т.- ферменты, катализирующие перенос групп, содержащих атом P (этот подкласс называют киназы). Большинство ферментов этого подкласса относятся к фосфотрансферазам, катализирующим перенос остатка фосфорной кислоты на различные акцепторы. Так, гексокиназа катализирует перенос остатка фосфорной к-ты с АТФ на группу ОН D-гексозы, 3-фосфоглицераткиназываютсяа-с АТФ на карбоксильную группу 3-фосфо-D-глицериновой к-ты.
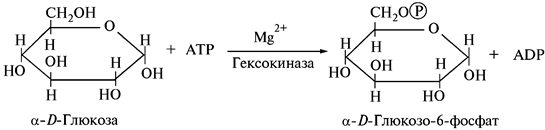
Фосфотрансферазы (киназы) активно используются в реакциях фосфорилирования белков (протеинкиназы), в качестве средств их химической модификации в процессах регуляции интенсивности и направления метаболизма. Присоединение Н3РО4 к соответствующим ферментам при помощи протеинкиназы меняет их активность, и в конечном итоге интенсивность реакции.
3. ГИДРОЛАЗЫ[1], класс ферментов, катализирующих гидролиз:
R1R2 + H2O → R1H + R2OH
Могут действовать на сложноэфирные и гликозидные связи, на связи С—О в простых эфирах, С—S в сульфидах, С—N в пет идах, и др.
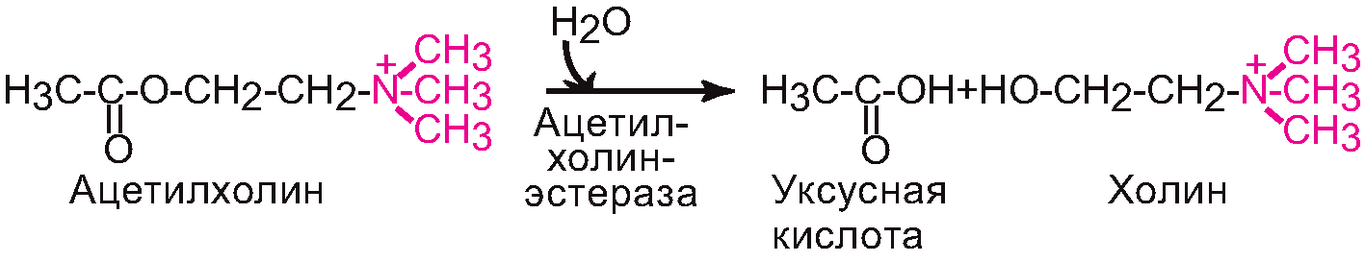
Г., катализирующие гидролиз сложноэфирных связей (эстеразы), действуют на сложные эфиры карбоновых и тио-карбоновых к-т, моноэфиры фосфорной к-ты и др. К этому подклассу относятся, в частности, ферменты, играющие важную роль в метаболизме липидов, нуклеиновых к-т и нуклеозидов, например ацетилхолинэстераза, липазы, фосфатазы, фосфолипазы и эндодезоксирибонуклеазы:
Наибольшую группу ферментов, расщепляющих гликозидные связи, представляют те, которые катализируют гидролиз олиго- и полисахаридов, напр. амилазы, лизоцим и нейраминидаза. Многие Г. этого подкласса специфичны к положению гликозидной связи и к конфигурации аномерного атома С углевода.
Ферменты, катализирующие гидролиз связи С—N в пептидах и белках (пептидгидролазы),- самая многочисленная группа Г. К ним относятся ферменты, отщепляющие одну или две аминокислоты с N- или С-конца полипептидной цепи (напр., аминопептидазы, карбоксипептидазы), а также эндопептидазы, или протеиназы, расщепляющие цепь вдали от концевых остатков. Последние классифицируют не по специфичности к субстрату, как остальные Г., а по типу каталитически активных групп в активном центре. В соответствии с этим различают сериновые, тиоловые, карбоксильные и металлзависимые протеиназы. Пептидгидролазы играют важную роль не только в катаболизме белков и пептидов, но и в биологической регуляции (гормональной регуляции, активации проферментов, регуляции кровяного давления и солевого обмена и т.д.).
Г.-белки с мол. м. от 10-15 до 200-300 КДа. Они проявляют свою каталитическую активность, как правило, в отсутствие каких-либо кофакторов; лишь в некоторых случаях необходимы ионы металлов-гл. обр. Zn2+, Co2+, Ca2+, Mg2+. Для небольшого числа Г. известна первичная, а для некоторых и пространственная структура молекулы (напр., для лизоцима, пепсина, трипсина, химотрипсина). Отмечено значительное сходство структуры ферментов одного подкласса, особенно в области активного центра. Так, многие протеиназываютсяы имеют в активном центре одинаковую последовательность аминокислот: Gly Asp Ser Gly Gly Pro. Близкое строение имеет и активный центр ряда эстераз.
Каталитически активными группами в Г. являются: группа ОН остатка серина в химотрипсине, панкреатической липазе, щелочной фосфатазе, аспарагиназе и др.; группа SH остатка цистеина, напр. в папаине; группа СООН остатков аспарагиновой и глутаминовой к-т в пепсине, лизоциме, карбоксипептидазе и др.; имидазольная группа остатка гистидина, напр. в рибонуклеазе, глюкозо-6-фосфатазе.
Г. находят применение в промышленности, медицине и сельском хозяйстве, напр. для получения сахарных сиропов из крахмала и целлюлозы, осветления и стабилизации соков и виноматериалов, лечения ожогов, заболеваний желудочно-кишечного тракта, тромбозов.
4. ЛИАЗЫ, класс ферментов, катализирующих реакции, в результате которых происходит разрыв связи С—С, С—О, С—N или др., сопровождающийся образованием двойных связей, а также обратные реакции - присоединения по двойным связям. Разрыв связи в этих реакциях не сопряжен с гидролизом или с окислительно-восстановительными превращениями. В тех случаях, когда преобладающей является реакция присоединения, ферменты называются синтазами (в отличие от синтетаз; см. Лигазы).
Подклассы Л. сформированы по типу расщепляемой связи, подподклассы - по природе элиминируемой в результате реакции молекулы (СО2, Н2О или др.).
Углерод-углерод Л. катализируют расщепление связи С—С. В этот подкласс входит обширная группа карбоксилиаз, катализирующих реакцию декарбоксилирования с элиминированием СО2, например оксалоацетатдекарбоксилаза, фосфоенолпируват-карбоксикиназа. Для многих карбоксилиаз кофакторы, принимающие участие в электрофоретическом катализе декарбоксилирования, - тиаминдифосфат и пиридоксаль-5'-фосфат (см. соотв. Тиамин и Витамин B6).
Альдегидлиазы, или альдолазы, катализируют альдольную конденсацию и обратную ей реакцию. Эти ферменты играют важную роль в обмене углеводов. Л. кетокислот (напр., изоцитратлиаза) катализируют гл. обр. синтез ди- и трикарбоновых к-т из двух и более фрагментов. Мн. из них играют важную роль в цикле трикарбоновых кислот и в глиоксилатном цикле.
Углерод-кислород Л. катализируют реакции, протекающие с расщеплением связи С—О. В этот подкласс входит группа гидролиаз, напр. фумарат-гидратаза и энолаза, катализирующие соотв. обратимые реакции гидратации фумаровой к-ты с образованием яблочной к-ты и фосфоенолпировиноградной к-ты с образованием 2-фосфо-D-глицерина.
Фосфор-кислород Л. катализируют отщепление пирофосфорной к-ты от нуклеозидтрифосфатов. Сюда входят нуклеотидилциклазы - аденилатциклаза и гуанилатциклаза. Эти ферменты участвуют в процессах регуляции клеточной активности. Существует еще несколько подклассов Л., которые представлены небольшим кол-вом ферментов.
6. ИЗОМЕРАЗЫ, класс ферментов, катализирующих реакции изомеризации. Подклассы И. (их пять) сформированы по типам реакций, а подподклассы по типам субстратов.
Рацемазы и эпимеразы катализируют соотв. рацемизацию и эпимеризацию веществ, в основном углеводов и АМК. (См. лекцию строение углеводов). Субстраты рацемаз содержат один хиральный центр, эпимераз несколько.
В группе эпимераз, катализирующих превращения углеводов, наиболее изучена альдоза-1-эпимераза, участвующая во взаимопревращении α - и β-моносахаридов, а также уридиндифосфатглюкоза-4-эпимераза (один из ферментов синтеза лактозы), катализирующая эпимеризацию глюкозы в положении 4 с образованием уридиндифосфатгалактозы. Одна из важных реакций эпимеризации - мутаротация глюкозы, катализируемая мутаротазой животных.
cis-trans-Изомеразы катализируют изомеризацию при двойных связях. Так, малеинатизомераза катализирует превращение малеиновой к-ты в фумаровую. Внутримолекулярные оксидоредуктазы катализируют окисление одной части молекулы с одновременным восстановлением другой части. Некоторые из этих И. используют в качестве кофермента восстановленный никотинамидадениндинуклеотидфосфат (NADРН). Поскольку в результате реакции не образуются окисленные продукты, эти ферменты не причисляются к классу оксидоредуктаз. К изомеразам этой группы относятся ферменты, катализирующие взаимопревращения альдоз и кетоз. Так, триозофосфат-изомераза катализирует превращение D-глицеральдегид-3-фосфата в дигидроксиацетонфосфат; глюкозо-6-фосфатизомераза катализирует взаимопревращение между глюкозо-6-фосфатом и фруктозо-6-фосфатом.
Внутримолекулярные трансферазы (часто называемые мутазами) катализируют перемещение групп из одного положения молекулы в другое. Например, превращение глюкозо-6-фосфата в глюкозо-1-фосфат при гликолизе катализируется фосфоглюкомутазой (фосфотрансферазой), осуществляющей внутримолекулярный перенос. Ряд ферментов этой группы катализирует перемещение аминогрупп. Мн. из них в качестве кофактора используют коферментные формы витамина В12.
6. ЛИГАЗЫ (синтетазы), класс ферментов, катализирующих присоединение друг к другу двух молекул; реакция сопряжена с расщеплением пирофосфатной связи в молекуле нуклеозидтрифосфата (NТP) - обычно АТP, реже гуанозин (GTP)-или цитозинтрифосфата (CTP). Подклассы Л. (их пять) сформированы по типам связей, которые образуются в результате реакции, а подподклассы - по типам субстратов. К Л., катализирующим реакции, в которых образуются связи С—О, относятся аминоацил-tRNA-синтетазы, катализирующие ацилирование транспортных RNA соответствующими аминокислотами.
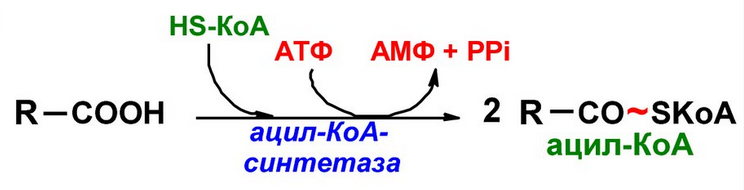
Образование связи С—S катализируют ферменты, участвующие в синтезе ацильных производных кофермента А (см. Пантотеновая кислота):
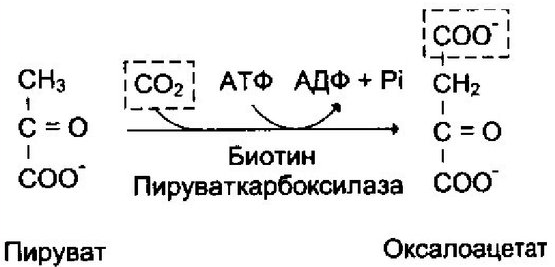
Реакции, в результате которых образуется связь С—С, катализируют карбоксилирующие ферменты, содержащие в качестве кофактора биотин, например пируваткарбоксилаза:
Катализируемые Л. реакции играют ключевую роль в процессах биосинтеза и функционирования всех организмов.
[1] Все ферменты пищеварения человека и животных относятся к классу гидролаз