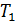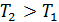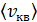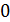ОГЛАВЛЕНИЕ
Введение …………………………………………………….……….………..3
Часть 1
МЕХАНИКА
1. Теоретическая часть
1.1 Кинематика поступательного и вращательного движения..…………..6
1.2. Динамика поступательного движения ………………………………..7
1.3. Динамика вращательного движения..………………………….………8
1.4. Работа и механическая энергия ….…………………………………......9
1.5. Законы сохранения …………………..……………………..…….....11
1.5.1. Закон сохранения импульса …...….…..………………………..... 11
1.5.2. Закон сохранения момента импульса.…….…………………...........12
1.5.3. Закон сохранения механической энергии.……..………….………..12
1.6. Механические колебания ……….…….……………………….............13
Часть 2
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
4. Теоретическая часть ………………………………………………...........45
4.1. Молекулярная физика
4.1.1. Основные параметры и уравнение состояния идеального газа..….45
4.1.2. Средняя энергия молекулы газа. Внутренняя энергия
идеального газа ……………………………………………………………....46
4.1.3. Распределение молекул идеального газа по скоростям – закон
Максвелла …………………………………………………………………...47
4.1.4. Явления переноса: диффузия, внутреннее трение,
теплопроводность …………………………………………………………...48
4.2. Термодинамика
4.2.1. Первое начало термодинамики. Работа газа и теплота ……….......49
4.2.2. Круговой процесс (цикл). Цикл Карно и его КПД..……………….51
4.2.3. Энтропия. Второе начало термодинамики. Расчет приращения энтропии ……………………………………………………………..……...52
В каждом параграфе в скобках дан номер экзаменацонного вопроса,
Таких вопросов 16 – из 20 по программе
ЧАСТЬ 2
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Молекулярная физика
Основные параметры и уравнение состояния идеального газа
(вопрос 27)
Молекулярная физика (МФ) и термодинамика (ТД) изучают строение и свойства вещества. Вещество – это макроскопическая система, состоящая из большого числа частиц: от 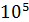 до
до 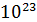 и более.
и более.
В молекулярно-кинетической теории (МКТ) используется модель идеальный газ, согласно которой
1) суммарный объем молекул мал по сравнению с объемом сосуда,
2) молекулы движутся хаотически и не взаимодействуют друг с другом,
3) соударения молекул между собой и со стенкой сосуда – абсолютно упругие.
Реальные газы при низких давлениях (до 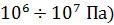 и высоких температурах (T
и высоких температурах (T 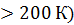 по своим свойствам близки к идеальному газу. Наиболее точно модели идеального газа соответствуют разреженные газы, особенно в условиях вакуума.
по своим свойствам близки к идеальному газу. Наиболее точно модели идеального газа соответствуют разреженные газы, особенно в условиях вакуума.
Уравнение состояния идеального газа – это уравнение Клапейрона–Менделеева:
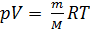 , (1)
, (1)
где p 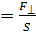 – давление газа, равное силе
– давление газа, равное силе 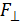 , с которой молекулы при ударах действуют по нормали на стенку сосуда площадью
, с которой молекулы при ударах действуют по нормали на стенку сосуда площадью 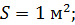 V – объем сосуда; m и M – масса газа и молярная масса (масса одного моля);
V – объем сосуда; m и M – масса газа и молярная масса (масса одного моля);  – количество вещества, оно измеряется числом молей
– количество вещества, оно измеряется числом молей 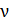 , которое равно также
, которое равно также 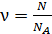 , где N – число молекул газа;
, где N – число молекул газа; 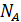 – число Авогадро;
– число Авогадро; 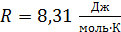 – молярная газовая постоянная; T – термодинамическая температура, измеряется в кельвинах (К),
– молярная газовая постоянная; T – термодинамическая температура, измеряется в кельвинах (К), 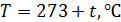 , где t – температура по Международной практической шкале, измеряется в градусах Цельсия (
, где t – температура по Международной практической шкале, измеряется в градусах Цельсия (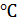 ).
).
Связь физических постоянных:
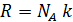 , (2)
, (2)
где 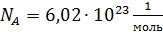 – число Авогадро, это число молекул в одном моле вещества;
– число Авогадро, это число молекул в одном моле вещества; 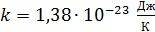 – постоянная Больцмана.
– постоянная Больцмана.
Введем параметр состояния газа 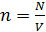 – концентрация молекул (их число в единице объема), и уравнение состояния идеального газа (1) запишем в виде:
– концентрация молекул (их число в единице объема), и уравнение состояния идеального газа (1) запишем в виде:
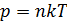 . (3)
. (3)
Концентрация молекул связана с плотностью газа ρ: 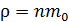 , где
, где 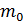 – масса одной молекулы; по определению плотность вещества
– масса одной молекулы; по определению плотность вещества 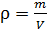 , а из уравнения состояния плотность идеального газа
, а из уравнения состояния плотность идеального газа
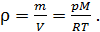 (4)
(4)
Средняя энергия молекулы газа.
Внутренняя энергия идеального газа
(вопрос 34)
Молекулы газа, совершая хаотическое движение, в соударениях изменяют свою скорость, поэтому в газе есть молекулы с различными скоростями в интервале от 0 до  (но следует иметь в виду, что даже большие скорости молекул
(но следует иметь в виду, что даже большие скорости молекул 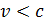 , равной
, равной 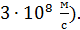 Соответственно, и кинетические энергии молекул газа различны. Поэтому вводят средние характеристики молекул. Согласно закону Больцмана о равномерном распределении энергии молекул по степеням свободы, средняя энергия молекулы
Соответственно, и кинетические энергии молекул газа различны. Поэтому вводят средние характеристики молекул. Согласно закону Больцмана о равномерном распределении энергии молекул по степеням свободы, средняя энергия молекулы 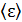 зависит от температуры газа T следующим образом:
зависит от температуры газа T следующим образом:
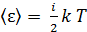 , (5)
, (5)
где i – суммарное число степеней свободы молекулы газа:
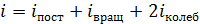 .
.
Для молекул при невысоких температурах (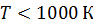 ) величина
) величина 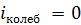 . Число степеней свободы молекулы связано с числом атомов в молекуле и ее структурой (см. таблицу).
. Число степеней свободы молекулы связано с числом атомов в молекуле и ее структурой (см. таблицу).
Таблица
| Газ | Одноатомный (He, Ne, Arи др.) | Двухатомный
(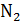 , , 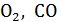 и др.) и др.)
| Трех- и многоатомный
(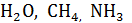 и др.) и др.)
|

| |||
| – | ||
| i |
Внутренняя энергия идеального газа U – это функция состояния газа, равная сумме кинетических энергий всех молекул, так как для невзаимодействующих молекул идеального газа 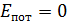 . Таким образом, величина внутренней энергии
. Таким образом, величина внутренней энергии
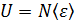 ;
;
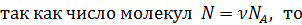 внутренняя энергия идеального газа
внутренняя энергия идеального газа
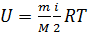 , (6)
, (6)
где m и M – масса газа и молярная масса; R – молярная газовая постоянная.
4.1.3. Распределение молекул идеального газа по скоростям –
Закон Максвелла
(вопрос 28 и в 27-й – ф-лы (9))
Закон Максвелла описывается функцией 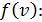
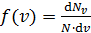 .
.
Здесь 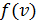 – функция распределения молекул по скоростям; она равна доле молекул, имеющих скорости в единичном интервале
– функция распределения молекул по скоростям; она равна доле молекул, имеющих скорости в единичном интервале 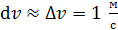 вблизи данной скорости
вблизи данной скорости 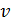 . Закон распределения молекул идеального газа по скоростям имеет следующий вид:
. Закон распределения молекул идеального газа по скоростям имеет следующий вид:
|
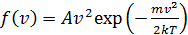 , (7)
, (7)
|
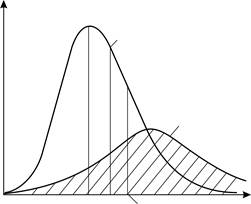
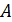 – постоянная, не зависящая от скорости; m – масса молекулы. На графике (рис. 16) функция (7) имеет вид кривой с максимумом.
– постоянная, не зависящая от скорости; m – масса молекулы. На графике (рис. 16) функция (7) имеет вид кривой с максимумом.
|
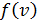
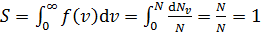 ,
,

|
|
|
|
|
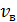 – наиболее вероятная скорость молекулы, она соответствует максимуму кривой распределения. Из условия максимума функции
– наиболее вероятная скорость молекулы, она соответствует максимуму кривой распределения. Из условия максимума функции 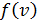 получена величина
получена величина
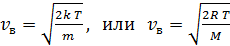 , (8)
, (8)
Средняя квадратичная скорость молекулы определяется по величине средней кинетической энергии поступательного движения молекулы (см. формулу (5)):
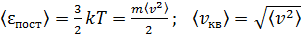 ;
; 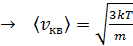 . (9)
. (9)
Средняя скорость молекулы  (средняя арифметическая скорость) определяется с помощью закона статистического распределения
(средняя арифметическая скорость) определяется с помощью закона статистического распределения 
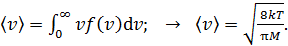 (10)
(10)
Сравнивая средние значения скоростей молекулы с учетом формул (8), (9) и (10), получаем соотношения, справедливые для молекул идеального газа и удобные в расчетах:
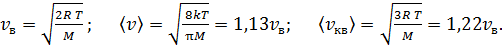 (11)
(11)