Глава 14
| ПРОСТЫЕ ЭФИРЫ |
Простыми эфирами называются такие производные спиртов, в которых водород гидроксильной группы замещен на углеводородный радикал.
14.1. Классификация и номенклатура
Классификация эфиров
| Ациклические эфиры | Циклические эфиры | ||
| симметричные | смешанные или несимметричные | эпоксиды или a-оксиды | циклические эфиры |
| Н3С-О-СН3 метоксиметан диметиловый эфир | 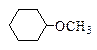 метоксициклогексан
метилциклогексиловый эфир
метоксициклогексан
метилциклогексиловый эфир
| 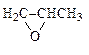 1,2-эпоксипропан
пропиленоксид
1,2-эпоксипропан
пропиленоксид
| 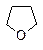 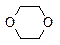 тетрагидрофуран 1,4-диоксан
тетрагидрофуран 1,4-диоксан
|
Номенклатура ИЮПАК.
· Заместительная номенклатура. По заместительной номенклатуре в простых эфирах типа ROR’ один радикал рассматриваются как углеводород-основа, а другой как R-окси-заместитель. Название таких заместителей образуется из названий углеводородных радикалов с добавлением окончания -окси. Для алкоксигрупп, содержащих от 1 до 4 углеродных атомов, используются сокращенные названия.
| CH3(CH2)4O- | CH2=CHCH2O- | CH3O- | 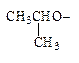
| 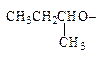
|
| пентилокси- | аллилокси | метокси- | изопропокси- | втор -бутокси- |
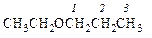 этоксипропан
этоксипропан
| 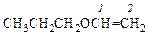 пропоксиэтен
пропоксиэтен
| 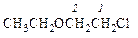 1-хлор-2-этоксиэтан
1-хлор-2-этоксиэтан
|
| За основу взята более длинная цепь. | За основу взята цепь с двойной связью. | За основу взята цепь с большим количеством заместителей. Начало нумерации – от первого по алфавиту заместителя. |
| пропилэтиловый эфир | винилпропиловый эфир | 2-хлорэтилэтиловый эфир |
§ Атом кислорода, присоединенный к двум соседним атомам углерода, называют префиксом -эпокси, отсюда название подобных соединений «эпоксиды ». Циклические эфиры обычно называют как гетероциклические соединения.
· Радикально-функциональная номенклатура. Название симметричных простых эфиров включает название радикала в форме прилагательного с добавлением числительного префикса ди- и названия функции эфир. Для несимметричных простых эфиров названия радикалов записывают в алфавитном порядке.
§ Эпоксиды в радикально-функциональной номенклатуре называют с использованием названий двухвалентных радикалов и функции -оксид.
Примеры таких названий даны выше курсивом.
14.2. Физические свойства простых эфиров
| В целом, пространственное строение простых эфиров подобно строению спиртов и воды. Угол между связями С–О–С не равен 180º и, следовательно, дипольные моменты двух связей С–О не компенсируют друг друга; вследствие этого простые эфиры имеют небольшой дипольный момент. Его наличие существенно не |
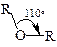
|
влияет на температуры кипения простых эфиров, которые близки к температурам кипения алканов с такой же молекулярной массой и значительно ниже температур кипения изомерных спиртов. Сравните, например, температуры кипения н -гептана (98 °С), метил- н -пентилового эфира (100 °С), и н -гексилового спирта (157 °С). В простых эфирах в отличие от спиртов нет ассоциации за счет образования межмолекулярных водородных связей.
Только два первых представителя эфиров – диметиловый и метилэтиловый эфиры – в нормальных условиях газы, остальные все жидкости. Плотность простых эфиров меньше плотности воды.
Растворимость простых эфиров и спиртов в воде примерно одинакова; например, и диэтиловый эфир, и н -бутиловый спирт растворяются в воде в количестве 8 г на 100 г воды. Растворимость низших спиртов в воде объясняют образованием водородных связей между молекулами спирта и воды; растворимость простых эфиров в воде можно объяснить аналогично:
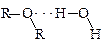
1,4-Диоксан содержит два эфирных атома кислорода на четыре атома углерода. Поэтому он образует значительно большее количество водородных связей с водой и может смешиваться с ней в любых соотношениях. Такое же свойство тетрагидрофурана объясняется большей доступностью неподеленной электронной пары атома кислорода по сравнению с диэтиловым эфиром благодаря циклической структуре тетрагидрофурана.
Растворимость простых эфиров в протонных кислотах обусловлена основными свойствами атома кислорода. Как и в случае атома азота в аммиаке, атом кислорода проявляет основные свойства вследствие наличия в его свите двух свободных электронных пар (у атома азота одна свободная пара электронов). Эти электронные пары не могут быть использованы для проявления обычной валентности, поскольку в молекуле эфира вокруг атома кислорода уже имеется восемь электронов (октет). Атом кислорода поэтому не может принять электроны, но может односторонне предоставить одну пару электронов в совместное обладание для осуществления связи, например, с протоном:

14.2.1. Спектроскопия простых эфиров
· УФ-спектроскопия. Эфирная связь не дает характерных полос колебания в видимой УФ-области спектра (λmax 180-190 нм).
· ИК-спектроскопия. В ИК-спектрах наблюдается очень сильное поглощение валентных асимметрических колебаний νС‑О 1150-1050 см-1.
· Масс-спектрометрия. В масс-спектрах простых эфиров интенсивность молекулярного иона в большинстве случаев мала. Фрагментация под действием электронного удара начинается с удаления электрона из неподеленной электронной пары кислорода. Затем идет фрагментация с образованием радикалов –ОСН3 (m/z 31), –ОС2Н5 (m/z 45), –ОС3Н7 (m/z 59) и т.д. Дальнейшее расщепление приводит к разрыву α-С–С связи, и радикалы отщепляются преимущественно от наиболее замещенных атомов углерода.
· Спектроскопия ПМР. Сигналы протонов в ряду –ОСН3, –ОСН2СН3 и –ОСН(СН3)2 в ПМР-спектрах смещается в сторону более слабого поля и проявляется в диапазоне 3,4-3,6 м.д.Значения химических сдвигов протонов в типичных циклических эфирах приведены ниже.
| 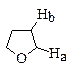
| 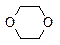
|
| d 2,54 м.д. | d 3,63 (а), 1,79 (b) м.д. | d 3,59 м.д. |
14.3. Получение простых эфиров
Некоторые симметричные простые эфиры, используемые в качестве растворителей, с небольшими алкильными группами, получают в промышленности. Наиболее важными из них являются диэтиловый эфир (со времен алхимиков он известен как серный эфир), применяемый как средство для наркоза, в качестве растворителя для экстракции и для получения реактивов Гриньяра, а также диизопропиловый и ди- н -бутиловый эфиры.
v Межмолекулярная дегидратация спиртов. Образование эфиров, а не алкенов при дегидратации спиртов достигается выбором соответствующих условий реакций. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 °С; диэтиловый эфир образуется при нагревании этой смеси при 140 °С, причем в реакционную смесь все время добавляют спирт, чтобы он был в избытке.
Образование простого эфира при дегидратации служит примером реакции нуклеофильного замещения, в которой протонированный спирт выступает в качестве субстрата, а вторая молекула спирта – в роли нуклеофила.
Теоретически реакция может протекать как по механизму SN1, так и по SN2 в зависимости от того, теряет ли протонированный спирт молекулу воды раньше или одновременно с атакой второй молекулы спирта. Вторичные и третичные спирты реагируют по SN1-механизму (1). Однако следует помнить, что в этих условиях, особенно третичные спирты, превращаются в алкены. Первичные спирты реагируют по механизму SN2 (2).
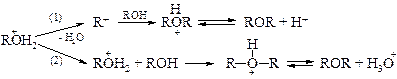
Так, из н -бутилового спирта получается ди- н -бутиловый эфир, т. е. реакция протекает без перегруппировки и, следовательно, преимущественно без образования промежуточных карбокатионов. В отличие от других вторичных и третичных спиртов изопропиловый спирт в условиях кислотного катализа дает неплохой выход диизопропилового эфира.
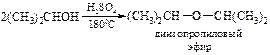
Применение реакции межмолекулярной дегидратации спиртов обычно ограничивается получением симметричных эфиров, поскольку при использовании двух различных спиртов образуется смесь трех эфиров: R-O-R, R-O-R' и R'-O-R'.
Кроме того, дегидратация в основном применяется для первичных низших спиртов, т.к. высшие спирты в этих условиях превращаются в алкены. Вторичные и третичные спирты вместо ожидаемых простых эфиров также в основном дают алкены.
§ Однако, варьируя условия синтеза и соотношение реагентов все же можно целенаправленно получать смешанные эфиры. Известно, что первичные спирты в зависимости от молекулярной массы способны в интервале от комнатной температуры до 100 °С образовывать с избытком серной кислоты моноалкилсульфаты.
С2Н5ОН + HOSO2OH → C2H5OSO2OH + H2O
Если далее температуру реакции поднять до 140 ºС и вносить избыток другого простейшего первичного спирта, то удается осуществить синтез смешанного эфира:
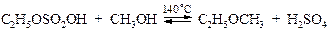
§ Кроме того, из аллилового спирта в смеси с каким-либо другим спиртом в присутствии тетрахлорплатиновой(II) кислоты селективно образуются алкилаллиловые эфиры.
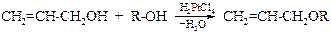
§ Если пропускать этанол над оксидом алюминия (дегидратирующим катализатором), нагретым до 375 ºС, то образуется вода и этилен, но при 250 ºС дегидратация приводит к простому эфиру.
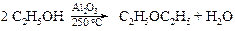
v Синтез Вильямсона. Несмотря на то, что эта реакция была открыта еще в 1852 г., она до сих пор остается наиболее общим методом получения простых эфиров. В лаборатории синтез Вильямсона в настоящее время является наиболее важным из-за его многосторонности: его можно использовать для синтеза каксмешанных, так и симметричных эфиров. В синтезе Вильямсона алкилгалогенид реагирует с алкоголятом натрия по схеме:
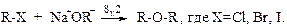
Реакция представляет собой нуклеофильное замещение иона галогена на алкоксид-ион; он аналогичен синтезу спиртов из галогеналканов при действии водного раствора щелочи. Например:
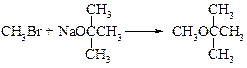
Если необходимо получить смешанные эфиры, то возможны две комбинации, причем одна из них почти всегда лучше. При синтезе, например, этил- трет -бутилового эфира возможны следующие комбинации:
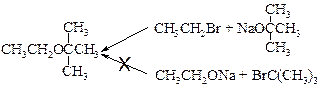
Какой же метод выбрать? Как всегда, следует учитывать возможность реакции элиминирования. Оно должно быть особенно существенным вследствие сильной основности алкоголят-иона. Поэтому третичный галогенид, который дает только или главным образом продукт элиминирования, не применяют; следует использовать другую комбинацию. Как известно, натрий медленно реагирует с трет -бутиловым спиртом. Однако это неудобство сполна компенсируется стремлением первичных галогеналканов вступать в реакцию замещения, а не элиминирования. При планировании синтеза эфира по Вильямсону следует помнить, что тенденция галогеналканов вступать в реакцию дегидрогалогенирования уменьшается в следующем порядке: третичный > вторичный > первичный.
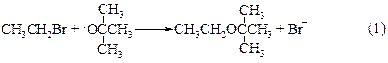
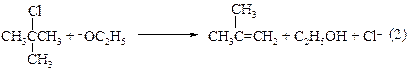
В случае (1) имеет место замещение, а в случае (2) – элиминирование. Последнего процесса можно избежать, если третичные галогеналканы этерифицировать в слабоосновных условиях, например, в пиридине или при использовании перхлората ртути.
При применении алкилтозилатов получение простых симметричныхи смешанных эфиров протекает весьма гладко и без осложнений:

v Синтез на основе алкенов. Спирты способны каталитически присоединяться к олефинам. В качестве катализатора выступают фторид бора(III) или неорганические кислоты. Таким способом синтезируют в промышленности диизопропиловый эфир, присоединяя пропанол-2 к пропену:
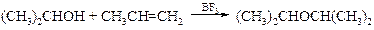
Метод пригоден для получения в промышленности и несимметричных простых эфиров:
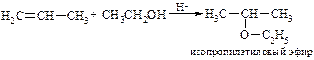
v Алкоксимеркурирование алкенов. Этот способ позволяет получать смешанные эфиры с высокими выходами:
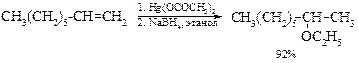
Реакция, по-видимому, начинается с атаки катионом +HgOCOCH3 двойной связи алкена, что ведет к образованию интермедиата – меркуриониевого катиона, который затем раскрывается в результате нуклеофильной атаки спирта по наиболее замещенному атому углерода.
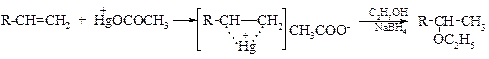
Для синтеза эфиров, содержащих вторичный или третичный алкил, следует использовать трифторацетат ртути(I):
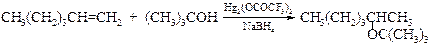
Этот наиболее распространенный способ получения простых эфиров напоминает гидратацию алкенов по правилу Марковникова посредством оксимеркурирования-демеркурирования, а различие сводится к тому, что реакция протекает в спирте, а не воде.
v Метилирование спиртов. Алкилметиловые эфиры получают взаимодействием спиртов с диазометаном в присутствии кислот Льюиса – BF3 или AlCl3, например:
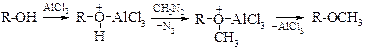
14.4. Химические свойства простых эфиров
Простые эфиры – нейтральные и малоактивные соединения, в связи с чем их часто используют в различных органических реакциях в качестве растворителей. Поскольку они в большинстве случаев не реагируют с натрием, то этот металл используют для сушки простых эфиров. На них не действуют разбавленные минеральные кислоты, щелочи. Эфиры не расщепляются металлорганическими соединениями, гидридами и амидами щелочных металлов. Немногие химические свойства этих соединений связаны с наличием свободной электронной пары у атома кислорода, что придает эфирам основные свойства, а также с наличием полярных связей С–О, разрыв одной из которых приводит к расщеплению простых эфиров.
v Образование солей оксония. Несмотря на то, что эфиры являются слабыми основаниями и плохими нуклеофилами. Они способны взаимодействовать с сухим хлороводородом с образованием солей диалкилгидроксония.
(C2H5)2O + HCl → (C2H5)2OH+Cl-
Образовавшаяся оксониевая соль, как соль слабого основания, роль которого играет молекула эфира, легко гидролизуется при разбавлении водой.
(С2Н5)2ОН+Сl- + H2O → (C2H5)2O + HCl
Об основном характере эфиров свидетельствует их растворимость в концентрированной серной кислоте и выделение при низкой температуре кристаллической оксониевой соли.
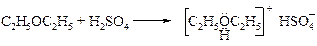
Эту реакцию применяют для отделения простых эфиров от алканов и галогеналканов.
§ В 1928 г. Х. Мейервейн открыл третичные оксониевые соли, которые можно получить из эфиров в результате следующей реакции:
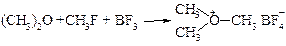
Роль галогенидов бора состоит в отщеплении галогена от галогеналкана и связывании его в прочный анион. Триалкилоксониевые соединения с комплексными анионами – твердые, вполне устойчивые солеобразные соединения. При попытке заменить анион в этих солях на анионы какой-либо обычной кислоты, т.е. при взаимодействии их с кислотами, солями и даже с водой, оксониевые соли распадаются с образованием простого эфира и алкилированного аниона. Триалкилоксониевые соли являются самыми сильными алкилирующими средствами (сильнее галогеналканов и диалкилсульфатов).
§ Эфир используют в качестве растворителя в реакции Гриньяра, т.к. он обладает способностью сольватировать и, таким образом, растворять реагент. Он выступает как основание по отношению к кислому атому магния.
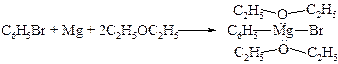
Диэтиловый эфир в этой реакции можно заменить на тетрагидрофуран.
Реактивы Гриньяра можно получить с хорошим выходом в бензоле в присутствии триэтиламина в качестве основания; требуется один моль основания на один моль галогеналкана.
§ Как основания Льюиса простые эфиры образуют комплексы, в которых эфир играет роль донора электронов, а галоген – акцептора. Так, раствор иода в диэтиловом эфире окрашен в коричневый цвет, в отличие от фиолетовой окраски в инертных растворах. Такие комплексы получили название комплексов с переносом заряда (КПЗ).
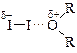
v Расщепление простых эфиров. Простые эфиры при нагревании до 140 ºС с концентрированными кислотами (H2SO4, HBr и, особенно, HI) способны подвергаться расщеплению. Эта реакция была открыта А. Бутлеровым в 1861 г. на примере 2-этоксипропановой кислоты.

Под воздействием иодоводородной кислоты эфир первоначально превращается в иодид диалкилгидроксония. Это приводит к увеличению полярности связей С–О и облегчению гетеролитического расщепления одной из них с образованием хорошей уходящей группы – молекулы спирта. Роль нуклеофила выполняет иодид-ион:
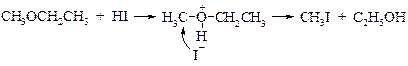
При расщеплении метил- и этилалкиловых эфиров действие нуклеофила направлено на более пространственно доступный метильный или этильный радикал. На этой особенности основан количественный метод Цейзеля – определение метокси- и этоксигрупп в органических соединениях.
Следует отметить, что если один из алкилов третичный, то расщепление идет особенно легко.
Реакция протонированного эфира с ионом галогена, так же как соответствующая реакция протонированного спирта, может протекать как по SN1, так и SN2-механизмам в зависимости от строения эфира. Как и следовало ожидать, первичная алкильная группа имеет тенденцию к SN2, в то время как третичная – к SN1-замещению:
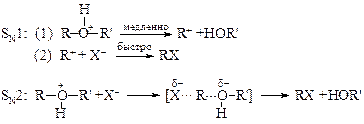
v Реакциипо a-водородному атому. Наличие в эфирах атома кислорода сказывается на поведении атомов водородов, особенно находящихся в α-положении. Такая региоселективность объясняется стабильностью радикала R-ĊH-Ö-R, где неспаренный электрон 2 р -орбитали углерода перекрывается с неподеленной парой 2 р -электронов атома кислорода.
Наиболее эффективно и избирательно протекают свободнорадикальные реакции хлорирования. Так, при обработке диэтилового эфира рассчитанным количеством хлора на свету образуется α-монохлорид.
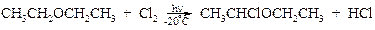
Скорость реакций α-хлорзамещенных эфиров на много порядков выше по сравнению с соответствующими галогеналканами. Они чрезвычайно легко вступают в реакции нуклеофильного замещения, особенно протекающие через образование устойчивого промежуточного карбокатиона, т.е. по механизму SN1. Эта устойчивость отражается резонансными структурами:
 .
.
Подобные реакции широко используют в органическом синтезе.
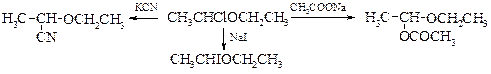
Примечательно, что, меняя условия проведения реакции, ее можно направить по пути дегидрогалогенирования с получением простых виниловых эфиров.
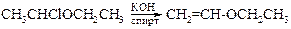
· Реакцииаутоокисления. Простые эфиры склонны к реакциям аутоокисления кислородом по радикальному механизму даже без облучения, что объясняется устойчивостью образующегося свободного радикала за счет делокализации неспаренного электрона углерода с электронной парой соседнего атома кислорода:
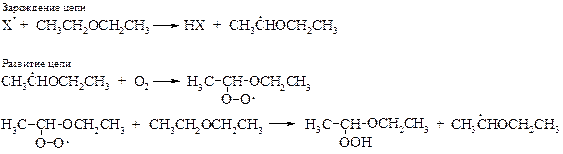
Особенно легко подвергаются аутоокислению эфиры, содержащие атом водорода у третичного углерода. Спонтанно образующиеся при стоянии гидропероксиды эфиров исключительно взрывоопасны. Будучи менее летучими, по сравнению с исходными эфирами, они не отгоняются вместе с эфирами, а накапливаются в колбе. По этой причине эфиры нельзя отгонять досуха, т. к. в противном случае может произойти взрыв. Гидропероксиды должны быть тщательно удалены из эфира с помощью восстановителей – солей железа(II) или олова(II).
Тестом на наличие пероксидов является обработка пробы эфира водным раствором иодида калия. Появление характерного коричневого окрашивания, а в присутствии крахмала – синего цвета указывают на присутствие гидропероксидов.
14.5. a-оксиды
Из циклических эфиров наиболее интересными свойствами обладают трехчленные циклы, называемые a-оксидами или эпоксидами.
Получение a-оксидов
Из органических оксидов практическое значение имеют этиленоксид и пропиленоксид. Для их синтеза существует два основных метода: дегидрогалогенирование галогенгидринов и окисление алкенов.
v Получениеa-оксидов из галогенгидринов осуществляют в присутствии сильных оснований.
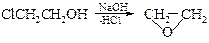
Исходный этиленхлоргидрин получают из этилена и хлорноватистой кислоты.
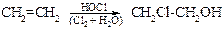
В сущности, реакция дегидрогалогенирования представляет собой внутримолекулярный синтез эфиров по Вильямсону, где оксид-анион, образующийся под действием основания, играет роль нуклеофильного агента, а галоген – уходящей группы.
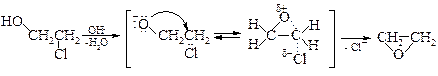
Необходимым условием этой реакции является транс -расположение гидроксила и атома хлора. Это позволяет кислороду атаковать атом углерода с тыла.
v Окисление алкенов считается наиболее перспективным методом получения циклических эфиров этилена и пропилена. В качестве окислителя применяют молекулярный кислород или надкислоты (реакция Прилежаева, 1909 г.):
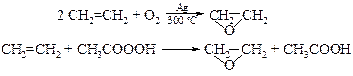
Окисление алкенов надкислотами протекает стереоспецифично: из транс -алкенов получаются транс -эпоксиды, из цис -алкенов – цис -эпоксиды.
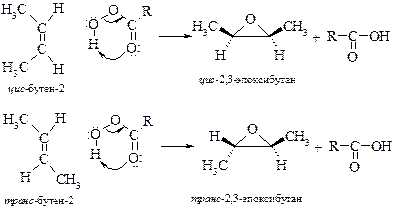
Химические свойства эпоксидов
Эпоксидное кольцо как и циклопропановый цикл очень напряжены, а сам цикл легко раскрывается. Такого искажения валентных углов нет в циклических эфирах с бóльшим числом атомов углерода, таких как тетрагидрофуран и тетрагидропиран. Поэтому они существенно менее реакционноспособны чем этиленоксид.
Для органических эпоксидов характерны реакции присоединения с расщеплением кольца по механизмам SN1 и SN2. Общая схема показана на примере этиленоксида. Протон из соединения НХ присоединяется к атому кислорода, а нуклеофильная составляющая в молекуле НХ – к электрофильному атому углерода.
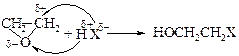
При кислотном катализе расщепление цикла протекает как по механизму SN1, так и механизму SN2, а при щелочном – только по SN2-механизму.
§ Общая схема расщепления эпоксидного кольца при кислотном катализе выглядит следующим образом:
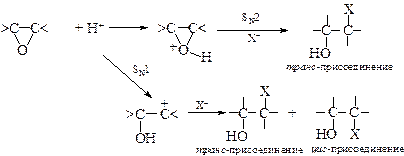
Определить SN1 механизм реакции помогает стереохимическая направленность. Отсутствие стереоспецифичности указывает на промежуточное образование карбокатиона. При наличии в оксирановом цикле заместителей в случае реализации механизма SN1 реакция идет через наиболее устойчивый карбокатион:
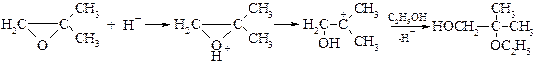
Другими словами, нуклеофильная атака при SN1 механизме направлена по наиболее замещенному атому углерода.
§ Механизм щелочного катализа выглядит следующим образом:
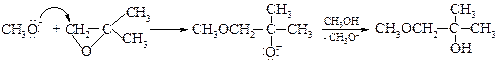
Метоксид-анион атакует менее замещенный атом углерода, т.к. он имеет больший положительный заряд. Заряд на соседнем атоме углерода делокализован +I-эффектом двух метильных групп, которые могут служить, кроме того, стерическим блокированием для подхода метоксид-аниона. Поэтому присоединение нуклеофила будет происходить только с противоположной стороны относительно атома кислорода и по механизму SN2.
§ Этиленоксид – важнейший синтон в органической химии. Из него можно получать этанол, этиленгликоль, гидроксипропаннитрил, уксусный альдегид, этаноламин, диоксан и т.д.
14.6. Краун-эфиры
В последние годы в лабораторной практике и технике большое значение приобрели краун-эфиры (от англ. сrown – корона). Они представляют собой макрогетероциклические соединения, содержащие в цикле 12 и более атомов, из которых не менее четырех – гетероатомы, связанные между собой метиленовыми мостиками. В тривиальных названиях общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят перед и после слова краун, например:
Простейшие краун-эфиры получают при конденсации дигалогенидов с дианионами диолов, например:
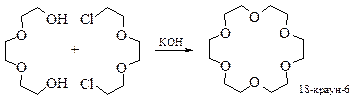
Выход краун-эфиров очень сильно зависит от катиона основания. Он играет решающую роль в размере цикла, который определяется координационным числом катионов. Координационное число калия по отношению к кислородсодержащим лигандам равно шести, поэтому катион калия наиболее эффективен при получении 18-краун-6-эфиров. Координационное число катиона лития равно четырем, поэтому он наиболее эффективен в случае краун-эфиров с тем же числом гетероатомов. Влияние катиона на размер образующегося цикла получило название матричного эффекта, который обусловлен соответствием размеров атомных радиусов катионов и внутренних полостей макроциклов.
Если один или несколько атомов кислорода заменены атомами азота или серы, соответствующие соединения называются азакраун- (А) или тиакраун-эфирами (Б). Краун-эфиры, конденсированные с бензольным и циклогексановым кольцами получили названия бензокраун- (В) и циклогексанокраун-эфиров (Г):
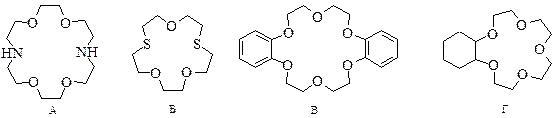
Как известно, соли неорганических кислот плохо растворимы в органических растворителях, и это ведёт к образованию гетерогенных систем, что отрицательно сказывается на эффективности реакций. Растворимость соединения, катион которого попадает в полость краун-эфиров, резко возрастает, что позволяет растворять соли щелочных и щелочноземельных металлов в малополярных растворителях. Анион в таком растворе слабо сольватирован, что приводит к повышению его нуклеофильности и основности. Эффективность этого процесса, т. е. образования комплексов краун-эфиров с катионами, зависит от соответствия диаметра катиона размеру полости кольца, а также координационного числа катиона металла. Увеличение с помощью краун-эфиров растворимости неорганических соединений и, тем самым, создание гомогенной среды позволяет реализовать в органической химии реакции, которые невозможны в других условиях:
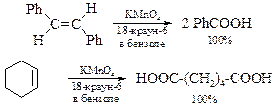
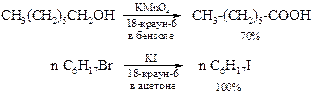
Перевод неорганических ионов из одной фазы в другую получил название межфазного катализа, а краун-эфиры – катализаторов межфазного переноса.
Краун-эфиры широко используют в разделении катионов экстракцией. В аналитической химии их применяют в качестве ионселективных электродов. На их основе создаются эффективные лекарственные препараты, позволяющие выводить из организма радиоактивные изотопы.
Растворение с помощью краун-эфиров нерастворимых в обычных условиях неорганических солей применяют в борьбе с закупорками при бурении скважин.
С помощью оптически активных краун-эфиров можно разделять рацемические смеси на антиподы. В органическом синтезе нашли применение макроциклические полиаминоэфиры – криптанды, образующие с катионами металлов соединения включения – криптаты.