1. Прямое воздействие галогенов на ароматические углкводороды.
Галогены могут реагировать с ароматическим углеводородом тремя путями:
а) присоединяться к двойным связям бензольного кольца;
б) замещать водородный атом бензольного конца с образованием галогенарила;
в) замещать водородный атом в алкильной группе боковой цепи с образованием арилалкилгалогенида.
При действии на ароматические углеводороды галогенов (хлор, бром) на холоду в присутствии катализаторов происходит замещение водородных атомов в ядре с выделением гелагеноводородов:
FeCl3
C6H6 + Cl2 → C6H6Cl + HCl
Катализатором при этом обычно является хлорид или бромид железа (ІІІ). В качестве катализаторов могут быть также использованы хлориды других металлов, такие, как AlCl3, SbCl3, SbCl5, а также иод.
Роль катализатора заключается в активации (поляризации) галогена, который осуществляет электрофильное замещение в бензольном ядре. В присутствии FeCl3 хлорирование идет, например, по схеме:
......
FeCl3 +:Cl::Cl: ↔ FeCl-4 + Cl:+
۠۠۠ ۠ ۠۠۠۠۠ ۠ ۠ ۠۠
C6H6 + Cl+ → C6H5Cl + H+;
H+ + Cl2 → HCl + Cl+ и т. д.
В боковую цепь можно ввести галоген в отсутствии катализаторов на свету или при нагревании. Механизм замещения в этом случае радикальный. Для толуола эти превращения могут быть выражены схемой:
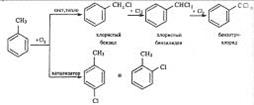
Галогены относятся к заместителям первого рода, и потому при галогенировании бензола второй атом галогена вступает преимущественно в n-положение к первому. Однако галогены в отличие от других заместителей первого рода затрудняют замещение (по сравнению с бензолом).
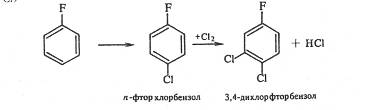
При хлорировании n-фторхлорбензола третий атом галогена вступает в о-положение к хлору, а не к фтору. Следовательно, решающее влияние на порядок замещения оказывает индукционный эффект галогена (о-положение к атому фтора имеет большой положительный заряд, так как –IF > -ICl):
2.Замена аминогруппы галогеном через промежуточное образование диазосоединений. Этот способ позволяет получать любые галогенпроизводные, в том числе и фторпроизводные:
Cu2Cl2
───→ C6H5Cl + N2
HONO + HCl KI
C6H5NH2───→ C6H5N2Cl ────→ C6H5I + KCl +N2
Cu2Br2
───→ C6H5Br + Cu2Cl2 + N2
[C6H5N2]BF4 → C6H5F + N2 + BF3
2.2 Адамантан
Структурные особенности адамантана определяют его необычные физические и химические свойства. Адамантан имеет самую высокую для углеводородов температуру плавления, равную 269°С, и плотность, равную 1,07 г/см3. Он термически устойчив в отсутствии кислорода при нагревании до 660°С. При давлении 20 килобар и температуре 480°С и выше он постепенно графитизируется. Адамантан исключительно стоек к агрессивным химическим средам и не взаимодействует с перманганатом калия, хромовой и концентрированной азотной кислотой даже при повышенной температуре.
В Таблице 1 показана зависимость выхода адамантана от применяемого катализатора.
Таблица 1. Результаты жидкофазной изомеризации ТМНБ в адамантан
| Условия реакции | Выход адамантана, % |
| BF3, HF, 23 ат Н2, 50°С | |
| SbF5, HF, 120°C, 5 ч | 47,2 |
| А1С13, Н2О | 43,2 |
| А1С13, НС1,40 ат Н2, 120°С | |
| А1С13, НС1, трет-С4Н9Сl | |
| BF3, HF | |
| AlCl3, HBr | |
| AICl3 | |
| А1С13 | 15–20 |
| А1Вr3, трет-С4Н9Вг | 25–30 |
Изомеризация ТМНБ в адамантан проводится по схеме:
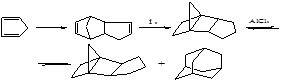
К дальнейшей перегруппировке в адамантан по пространственным соображениям способен только эндо-изомер, а его равновесная концентрация составляет около 0,5 масс. %.
В кинетическом отношении изомеризация эндо-ТМНБ – одна из самых медленных перегруппировок насыщенных углеводородов в этих условиях: геометрическая изомеризация ТМНБ (перегруппировка Вагнера-Меервейна) протекает быстрее примерно в 10000 раз.
Этот способ синтеза стал основой для промышленной технологии адамантана. Легкость такой перегруппировки объясняется, высокой термодинамической стабильностью адамантана, поэтому обработка всех известных изомеров C10H16 кислотами Льюиса неизбежно приводит к этому полициклическому каркасному углеводороду.