Выполните упражнение письменно – присылаете на проверку
24 апреля до 16.00:
1.Изобразите структурные формулы сложных эфиров уксусной кислоты и следующих спиртов:
а) метанола, б) изо-пропанола, в) глицерина. Назовите их.
2.Напишите следующие уравнения реакций:
а) этерификации этанола и муравьиной кислоты,
б) щелочного гидролиза этилового эфира масляной кислоты,
в) гидролиза метилового эфира пропионовой кислоты,
г) восстановления изопропилового эфира пропионовой кислоты.
Сложные эфиры.
Все спирты взаимодействуют с кислотами, образуя соединения, называемые сложными эфирами. Способность образовать сложные эфиры, является характерным свойством, как всех спиртов, так и всех кислот.
Сложными эфирами - называются органические вещества, которые образуются при взаимодействии кислот со спиртами, идущими с отщеплением воды.
Общая формула: R – C = O
O – R
Номенклатура.
а) Систематическа я номенклатура: название УВ радикала (от спирта) + корень латинского названия кислоты + ат.
б) Рациональная номенклатура: спирт + эфир + кислота
в) Историческая: кислота + спирт + эфир
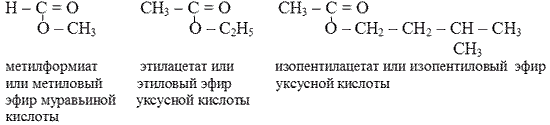
Изомерия
Для сложных эфиров характерна только структурная изомерия.
1-й вид – изомерия углеродного скелета
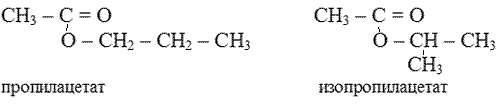
2-й вид - межклассовая изомерия с карбоновыми кислотами:
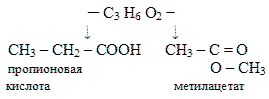
Получени сложных эфиров
1. Реакция этерификации - реакция образования сложных эфиров при взаимодействии кислот и спиртов.
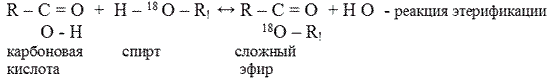
Этерификации сопутствует обратный процесс – гидролиз сложных эфиров. Он состоит в том, что при взаимодействии сложного эфира с водой снова образуется кислота и спирт. Т.о., данная реакция является обратимой. И, чтобы сместить равновесие в сторону получения сложного эфира, необходимо из реакционной смеси удалять воду. Реакция этерификации, также ускоряется при действии катализаторов – минеральных кислот, например серной.
2. Взаимодействием хлорангидрида со спиртом:
СН3-С=О + C2H5-OH = CH3-C=O + HCl
Cl O-C2H5
Нахождение в природе и физические свойства.
Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легко кипящие жидкости с фруктовыми запахами. У эфиров не водородных связей. Высшие сложные эфиры – воскообразные вещества (пчелиный воск). Все сложные эфиры плохо растворимы в воде.
Сложные эфиры – вещества, широко распространенные в природе, но обычно в небольшом количестве. Они участвуют в разнообразных процессах, протекающих в организме, и являются ароматизирующими компонентами ряда растений. Приятные ароматы цветов, плодов и ягод в значительной степени обусловлены присутствующими в них сложными эфирами.
В значительных количествах в природе представлены только сложные эфиры высокомолекулярных спиртов и кислот – воски.
Химические свойства.
1.Характерное свойство сложных эфиров –взаимодействие их с водой - гидролиз
а) Гидролиз кислотный:
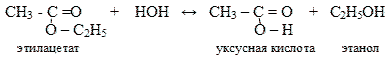
б) Щелочной гидролиз: в щелочной среде реакция также идет быстрее.
СН3- COО-СН3 + NaOH→ CH3- COONa + H2О
2.Реагируют с аммиаком:
СН3- COО-СН3 + NH3  CH3- C=O + CH3-OH
CH3- C=O + CH3-OH
NH2
3.Восстановление сложных эфиров:
[H]
СН3- COО-СН3 → CH3- CН2 OH + CH3-OH
4.Эфиры хорошо горят:
2CH3-C=O + 7O2 = 6CO2 + 6H2O
O-CH3
Применение сложных эфиров.
1.В парфюмерии.
2.Лекарственные вещества.
3.Растварители: этилацетат
4.Волокна и пластмассы.
5.Пищевая промышленность – эссенции.