в углеводы при прорастании семян масличных растений
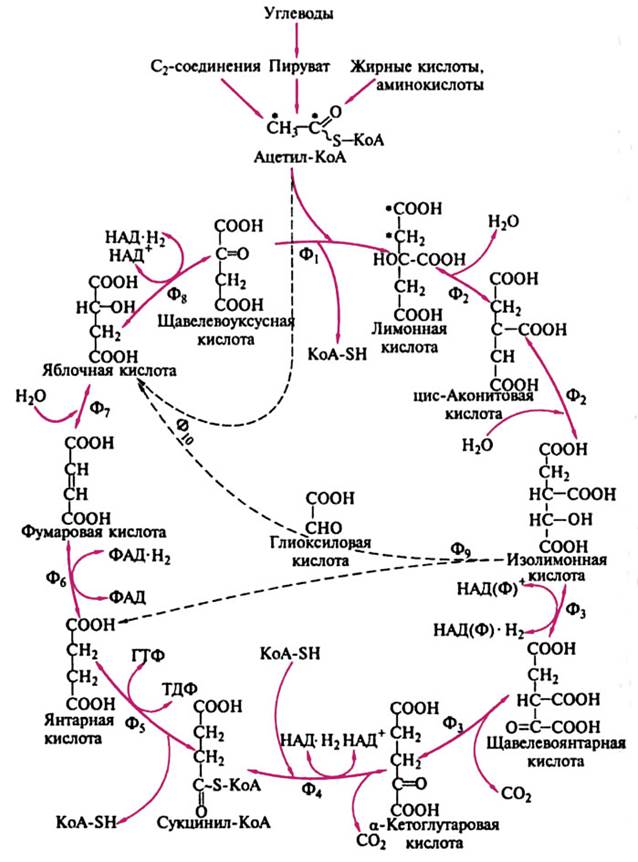
Схема глиоксилатного цикла
Окислительный пентозофосфатный цикл. Глюкозо-6-фосфат, образованный в начале гликолиза в результате фосфорилирования глюкозы, может подвергаться дальнейшим преобразованиям в окислительном пентозофосфатном цикле (не смешивать с восстановительным пентозофосфатным циклом при фотосинтезе – циклом Кальвина).

схема пентозофосфатного цикла
1 – глюкозо-6-фосфатдегидрогеназа, 2 – глюконолактоназа, 3 – фосфоглюконатдегидрогеназа, 4 – фосфопентоэпимераза, 5 – фосфопентоизомераза, 6,8 – транскетолаза, 7 – трансальдолаза, 9 – триозофосфатизомераза, 10 – альдолаза, 11 – фосфатаза, 12 - гексофосфатизомераза
Пентозофосфатный путь окисления глюкозы (ПФП), или гексозомонофосфатный шунт, часто называют апотомическим окислением в отличие от гликолитического цикла, называемого дихотомическим (распад гексозы на две триозы). Реакции ПФП протекают в растворимой части цитоплазмы клеток, а также в пропластидах и хлоропластах. ПФП наиболее активен в тех клетках, где интенсивно идут синтезы: липидных компонентов клеточных мембран, нуклеиновых кислот, компонентов клеточных стенок, фенольных соединений и др. АТФ в ПФП используется только для образования исходного соединения – глюкозо-6-фосфата; ни в одной реакции этого цикла АТФ не образуется. ПФП – циклический процесс, поскольку окисление глюкозы сопровождается регенерацией исходного субстрата – глюкозо-6-фосфата. Цикл условно можно разделить на две фазы: непосредственно окислительную и регенерации. Первая включает превращение глюкозо-6-фосфата и двух молекул НАДФ в рибулозо-5-фосфат, две молекулы НАДФ-Н и СО2. Вначале глюкозо-6-фосфат окисляется дегидрогеназой, в результате чего образуются НАДФ-Н и 6-фосфоглюконовая кислота, которая затем подвергается декарбоксилированию с образованием пятиутлеродных фосфорилированных сахаров (рибозо-5-фосфат) и СО2.
Рибозо-5-фосфат способен переходить в ходе реакции изомеризации в кетоформу рибулозо-5-фосфат. Эти сахара выполняют в клетке разные функции: они включаются в полимеры клеточной стенки (пентозаны), расщепляются при обмене веществ с образованием СО2, Н2О и АТФ, включаются в нуклеотиды РНК и ДНК или участвуют в синтезе высокоэнергетических соединений, таких, как АТФ.
В фазе регенерации участвуют только фосфорные эфиры сахаров, причем те же, что и в фотосинтетическом цикле Кальвина. В ходе процесса образуются седогептулозо-7-фосфат, эритрозо-4-фосфат, фруктозо-6-фосфат и ФГА. Наличие общих промежуточных продуктов в цикле Кальвина и ПФП свидетельствует о том, что эти соединения могут переходить в случае необходимости из одного цикла в другой. Совокупность реакций ПФП заключается в том, что из шести молекул глюкозо-6-фосфата одна молекула окисляется до СО2, а остальные пять регенерируют вновь и выходят из цикла. При этом восстанавливаются 12 молекул НАДФ. Суммарное уравнение ПФП выглядит так:
6 глюкозо-6-фосфат + 12НАДФ+ + 7Н2О ®
5 глюкозо-6-фосфат + 6СО2 + 12НАДФ Н + 12Н+ + Н3РО4.
ПФП представляет собой анаэробное окисление, сопровождаемое в отличие от гликолиза выделением СО2. Этот процесс, так же как и гликолиз, локализован в цитоплазме, но частично происходит и в пластидах. В цикле восстанавливаются 12 молекул НАДФ, и в результате транспорта электронов от НАДФ-Н по дыхательной цепи митохондрий синтезируется 12 • 3 = 36 молекул АТФ. Чистый выход энергии за вычетом молекулы АТФ, потраченной на фосфорилирование глюкозы, составляет 35 молекул АТФ.
Основное назначение ПФП состоит в участии не столько в энергетическом, сколько в пластическом обмене клетки:
1. НАДФ-Н используется главным образом в различных синтетических реакциях. ПФП служит основным внемитохондриальным и внехлоропластным источником НАДФ-Н, который необходим для синтеза жирных кислот, жиров, изопреноидов, для восстановительного карбоксилирования пирувата, восстановления нитрата и сульфата и т.д. НАДФ-Н играет значительную роль в поддержании восстановленности SH-соединений в клетке, поскольку является первичным восстановителем глутатиона.
2. В ходе ПФП синтезируются пентозы, входящие в состав нуклеиновых кислот и различных нуклеотидов (пиридиновых, флавиновых, адениловых м др.). для гетеротрофных организмов ПФП – единственный способ образования пентоз (рибоз и дезоксирибоз) в клетке. Рибозы необходимы для синтеза АТФ, ГТФ, УТФ и других нуклеотидов. Коферменты НАД, НАДФ, ФАД, коэнзим А – тоже нуклеотиды, в состав которых входит рибоза.
3. ПФП имеет большое значение как источник образования углеводов с различным числом атомов углерода в цепи (от С3 до С7). Эритрозо-4-фосфат, возникающий в ПФП, необходим для синтеза шикимовой кислоты – предшественника многих ароматических соединений, таких, как ароматические аминокислоты, витамины, дубильные и ростовые вещества. лигнин клеточных стенок и др.
4. Компоненты ПФП (рибулозо-1,5-дифосфат, НАДФ-Н) принимают участие в темновой фиксации СО2. По существу ПФП представляет собой обращенный фотосинтетический (восстановительный) цикл Кальвина. Только 2 из 15 реакций цикла Кальвина специфичны для фотосинтеза, остальные участвуют в окислительном ПФП дыхания и гликолизе.
5. В хлоропластах окислительный ПФП функционирует в темноте, предотвращая резкое изменение концентрации НАДФ-Н в отсутствие света. Кроме того, триозофосфаты этого цикла в хлоропластах превращаются в 3-ФГК, что важно для поддержания в них уровня АТФ в темноте.
В регуляции скорости пентозофосфатного цикла наряду с концентрацией Рн, контролирующего также гликолиз, важную роль играет содержание НАДФ+, которое тесно коррелирует со скоростью ПФП. Так, например, восстановительное аминирование кетокислот, как и другие биосинтезы, протекающие с использованием НАДФ-Н и соответственно увеличением НАДФ+, активирует ПФП. Важную роль в переключении с гликолиза на ПФП играет эритрозо-4-фосфат.
Субстратное фосфорилирование – это синтез богатых энергией фосфорных соединений за счет энергии окислительно-восстановительных реакций гликолиза (катализируемых фосфоглицеральдегиддегидрогеназой и енолазой) и при окислении α -кетоглутаровой кислоты в цикле трикарбоновых кислот (под действием α -кетоглутаратдегидрогеназы и сукцинаттиокиназы). Субстратное фосфорилирование, в отличие от фосфорилирования в цепи переноса электронов не связано с фиксацией ферментов в мембранах митохондрий.
Тема 2 Дыхательная цепь и окислительное фосфорилирование
1. Строение электрон-транспортной цепи митохондрий
2. Окислительное фосфорилирование
3. Дыхание и обмен веществ в растительной клетке
1 Строение электрон-транспортной цепи митохондрий
В процессе распада органических веществ происходит синтез АТФ (субстратное фосфорилирование) и восстановление коферментов: НАД, ФАД и НАДФ. Сам распад дыхательного субстрата происходит без участия кислорода воздуха, хотя цикл Кребса, пентозофосфатный и глиоксилатный, осуществляются только в условиях достаточного снабжения клеток кислородом. Часть энергии, освободившейся при распаде дыхательного субстрата, запасается в макроэргических связях АТФ, но большая ее часть содержится в восстановленных коферментах. Восстановленные коферменты могут окисляться с образованием воды и одновременным синтезом АТФ или служить донорами водорода для восстановительных процессов, протекающих в клетках.
Для окисления восстановленных коферментов используется атмосферный кислород. Окисление восстановленных коферментов с помощью кислорода воздуха – последний этап дыхания. Он происходит в результате потери водорода (дегидрирования) восстановленными коферментами, причем атомы водорода прежде всего расщепляются на электроны и протоны: Н→Н++е-; протон Н+ переходит в межмембранное пространство митохондрии, а электрон передается с помощью специальных переносчиков кислороду воздуха, который вместе с протоном из матрикса митохондрии образует молекулу воды: 4Н++4е-+О2→2Н2О. Переносчиками являются ферменты – пиридиновые и флавиновые дегидрогеназы, коферментами которых соответственно служат НАД или НАДФ, ФАД или ФМН, а также железосерные белки, убихинон и цитохромы. Переносчики могут находиться в восстановленном или окисленном состоянии, они попеременно являются то донорами, то акцепторами электронов. Кислород – конечный акцептор электронов, в чем и состоит его роль в дыхании.
В дыхании участвует несколько цитохромов, различающихся по природе гема и обозначаемых как цитохром а, цитохром а3, цитохром b, цитохром с, цитохром с1. Атом железа, присоединяя электрон, переходит из окисной формы (Fe3+) в закисную (Fe2+), а теряя его, опять окисляется. Непосредственно с кислородом воздуха взаимодействует только цитохром-оксидаза.
Вторую важную группу переносчиков образуют железосерные белки, в молекулах которых 2 или 4 атома железа связаны с таким же числом атомов серы и с радикалами цистеина, образуя железосерный центр белка.
Переносчики образуют электронтранспортную, или дыхательную, цепь, которая встроена во внутреннюю мембрану митохондрий подобно тому, как переносчики, работающие в световой фазе фотосинтеза, расположены на тилакоидах гран и тилакоидах стромы хлоропласта.

Порядок расположения компонентов цепи зависит от величины их окислительно-восстановительных потенциалов.
Окислительно-восстановительный потенциал Е0 характеризует сродство молекулы переносчика к электронам. В начале цепи расположен НАДН, так как его редокс-потенциал равен -0,32 В, что указывает на сильно выраженную способность отдавать электроны. Окислительно-восстановительный потенциал кислорода воздуха +0,82 В, что означает тенденцию к принятию электронов, поэтому он является их конечным акцептором. Остальные переносчики располагаются между НАДН и кислородом в порядке последовательного повышения положительного потенциала. У цитохромов редокс-потенциал выше, чем у железосерных центров, поэтому железосерные белки располагаются в цепи ближе к НАДН-концу. Итак, редокс-потенциал увеличивается в дыхательной цепи от одного переносчика к другому.
Каждый компонент должен располагаться в цепи так, чтобы он мог принять электрон и передать его следующему. Следовательно, необходимы упорядоченность и плотная упаковка молекул в мембране. Нарушение в любой точке электрон-транспортной цепи полностью блокирует весь транспорт электронов. Движущей силой транспорта электронов является разность окислительно-восстановительных потенциалов между НАДН и кислородом воздуха.
Переносчики, за исключением убихинона и цитохрома с, образуют во внутренней мембране митохондрии четыре комплекса.
Комплекс I –НАДН-дегидрогеназный комплекс; самый большой, содержит более 22 полипептидных цепей, а также флавинмононуклеотид и 5 железосерных центров. Этот комплекс переносит электроны от НАДН через ФМН и железосерные белки на убихинон. Одновременно этот комплекс переносит и протоны.
Комплекс II содержит ФАД-зависимую сукцинат – убихинон – оксидоредуктазу и три железосерных белка. Этот комплекс катализирует окисление сукцината - янтарной кислоты.
Убихинон, или кофермент Q, – самый простой переносчик электронов. Это небольшая гидрофобная молекула, растворенная в липидном бислое мембраны. Молекула убихинона имеет форму кольца с двумя присоединенными к нему атомами кислорода. Она может находиться в трех состояниях: окисленном, полувосстановленном и восстановленном. Убихинон может принять или отдать как один, так и два электрона и временно захватить из окружающей водной среды протон при переносе каждого электрона. Когда он отдает электрон другому переносчику, протон освобождается. Убихинон передает электроны от первого и второго комплексов третьему.
Комплекс III (комплекс b – с1) состоит из 8 разных полипептидных цепей и является димером. В состав комплекса входят цитохромы b, c1 и железосерный белок. Этот комплекс переносит электроны от восстановленного убихинона к цитохрому с.
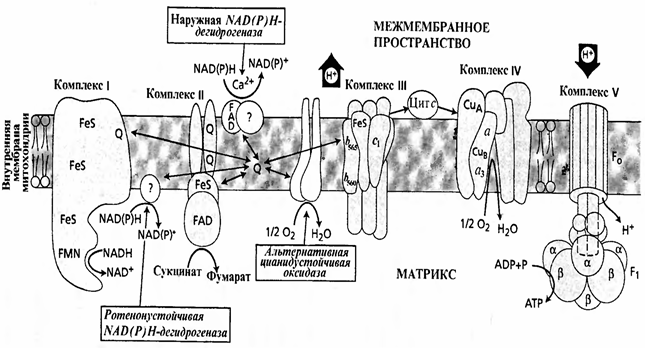
Цитохром с – небольшой водорастворимый белок, располагается на обращенной к межмембранному пространству стороне внутренней мембраны митохондрии между комплексами III и IV. Цитохром с переносит электроны на комплекс IV; в присутствии убихинона он переносит через мембрану и протоны.
Комплекс IV (цитохромоксидазный комплекс) наиболее изучен. Это димер, состоящий из 8 полипептидных цепей. Каждый мономер содержит 2 цитохрома: а и и 2 атома меди. Этот комплекс получает электроны от цитохрома с и передает их кислороду воздуха. Транспорт электронов через данный комплекс сопряжен с транспортом протонов через внутреннюю мембрану митохондрии в межмембранное пространство. Этот процесс ингибируется цианидом, азидом и СО.
Убихинон и цитохром с могут быстро перемещаться в результате диффузии в плоскости мембраны, как челноки, от одного ферментного комплекса к другому и переносить электроны.
Комплексы I, III и IV пересекают мембрану. Электроны переносятся последовательно от одного комплекса к другому и потом на кислород воздуха, имеющий наибольшее сродство к электронам. При переходе электрона от одного переносчика к другому освобождается энергия, количество которой прямо пропорционально разности между их редокс-потенциалами. Ферментные комплексы используют эту энергию для перекачивания протонов через внутреннюю мембрану митохондрии в межмембранное пространство. Каждый комплекс содержит трансмембранные белки, прочно закрепляющие его во внутренней мембране митохондрии, и ориентирован так, чтобы все протоны перемещались в одном направлении: из матрикса наружу. Специфическая ориентация в бислое свойственна всем мембранным белкам и очень важна для выполнения их функций.
Как работает дыхательная цепь?
НАДН – главный источник электронов, переносимых дыхательной цепью. Он входит в состав НАДН-дегидразного комплекса и располагается на внутренней стороне мембраны. Каждая молекула НАДН несет не просто атом водорода, а водородный атом плюс добавочный электрон (гидрид-ион). Из-за того, что в матриксе митохондрии всегда есть свободные протоны, перенос гидрид-иона от НАДН эквивалентен (равносилен) переносу двух атомов водорода. Перенос электронов по дыхательной цепи начинается с отнятия гидрид-иона от НАДН. При этом образуется НАД+, а гидрид-ион превращается в протон и 2 электрона. Два электрона и два протона –один от НАДН и один из матрикса митохондрии – передаются на ФМН первого комплекса. Протоны переносятся через мембрану в межмембранное пространство, а электроны передаются на железосерные центры, а затем на 2 молекулы окисленного убихинона, которые присоединяют 2 протона, образуя семихиноны. Семихиноны диффундируют к комплексу III. К этим семихинонам поступает еще пара электронов от цитохрома b третьего комплекса. Теперь семихиноны могут присоединить еще 2Н+ из матрикса митохондрии, и образуются 2 молекулы полностью восстановленного убихинона. Полностью восстановленный убихинон отдает 2е- цитохрому b и 2е- цитохрому c1. В результате освобождаются 4Н+, которые выходят в межмембранное пространство митохондрии. Окисленные молекулы убихинона диффундируют к комплексу I и могут опять принимать от него электроны и протоны. Эти превращения убихинона получили название Q-цикла.
Цитохром с, получив 2e- от цитохрома с1 передает их на цитохром а комплекса IV. Цитохром a3, связывая кислород, переносит на него эти электроны, в результате присоединяются 2НТ и образуется вода. Цитохромоксидазный комплекс тоже способен переносить Н + через мембрану.
Таким образом, во время транспорта каждой пары электронов от НАДН к 1/2 O2 в трех участках дыхательной цепи (комплекс I, III, IV) через внутреннюю мембрану митохондрии переносятся, по крайней мере, 3 пары протонов. Следовательно, дыхательная цепь работает как протонная помпа.
Поскольку редокс-потенциал ФАДН2 близок к 0 В, перенос двух электронов от него на убихинон в комплексе II не сопровождается переносом протонов. Поэтому во время транспорта электронов от ФАДН2 к кислороду через мембрану переносится только 2 пары протонов.
В растительных митохондриях есть НАДФ-зависимая дегидрогеназа. Если в дыхательную цепь включается НАДФН, то он окисляется, передавая водород на НАД+. Дальше транспорт электронов идет так же, как при окислении НАДН.
Итак, дыхательный субстрат и кислород воздуха не взаимодействуют непосредственно, между ними лежит дыхательная цепь, встроенная во внутреннюю мембрану митохондрии. Полная цепь состоит из 80 белковых молекул, две трети которых выполняют структурную роль и функцию сопряжения. Остальные являются переносчиками электронов и протонов.
В результате присоединения к кислороду электронов, передаваемых по дыхательной цепи, и протонов из матрикса митохондрии образуется молекула воды: 4Н++4е-+О2→2Н2О, называемая метаболической. У таких растений, как суккуленты, выдерживающих засуху благодаря накоплению воды в тканях листьев, стеблей или корней, она играет важную роль в водном балансе организма.
 Описанный путь транспорта электронов – главный, он получил название цитохромного. Кроме него, в растениях существует еще другой путь переноса электронов – альтернативный, когда электроны от убихинона передаются на кислород воздуха с помощью альтернативной оксидазы; цитохромы не участвуют.
Описанный путь транспорта электронов – главный, он получил название цитохромного. Кроме него, в растениях существует еще другой путь переноса электронов – альтернативный, когда электроны от убихинона передаются на кислород воздуха с помощью альтернативной оксидазы; цитохромы не участвуют.
Схема движения электронов при окислительном фосфорилировании
2 Окислительное фосфорилирование
Движение электронов по дыхательной цепи вызывает перекачивание протонов через внутреннюю мембрану из матрикса митохондрии в межмембранное пространство. Согласно хемиосмотической теории П. Митчела, существует прямая связь между химическими процессами и транспортными.
 Перенос протонов через внутреннюю мембрану приводит к двум важным результатам. Во-первых, между сторонами внутренней мембраны создается градиент pH: в матриксе величина pH выше, чем в межмембранном пространстве. Так как протоны легко проходят через наружную мембрану митохондрии, величина pH в цитозоле будет такой же, как в межмембранном пространстве. Во-вторых, на внутренней мембране создается разность потенциалов – мембранный потенциал, причем внутренняя сторона мембраны заряжается отрицательно, а наружная – положительно. В результате возникает электрохимический протонный градиент (ΔμН+). Таким образом, электрохимический прогонный градиент состоит из мембранного потенциала (ΔΨ) и градиента концентрации протонов (ΔрН). Обе силы стремятся перемещать протоны обратно в матрикс митохондрии. Однако внутренняя мембрана митохондрии непроницаема для протонов, поэтому они могут попасть обратно в матрикс только с помощью АТФазы.
Перенос протонов через внутреннюю мембрану приводит к двум важным результатам. Во-первых, между сторонами внутренней мембраны создается градиент pH: в матриксе величина pH выше, чем в межмембранном пространстве. Так как протоны легко проходят через наружную мембрану митохондрии, величина pH в цитозоле будет такой же, как в межмембранном пространстве. Во-вторых, на внутренней мембране создается разность потенциалов – мембранный потенциал, причем внутренняя сторона мембраны заряжается отрицательно, а наружная – положительно. В результате возникает электрохимический протонный градиент (ΔμН+). Таким образом, электрохимический прогонный градиент состоит из мембранного потенциала (ΔΨ) и градиента концентрации протонов (ΔрН). Обе силы стремятся перемещать протоны обратно в матрикс митохондрии. Однако внутренняя мембрана митохондрии непроницаема для протонов, поэтому они могут попасть обратно в матрикс только с помощью АТФазы.
АТФ-синтетаза составляет около 15 % всего белка внутренней мембраны митохондрии. Она состоит не менее чем из 9 субъединиц, пять из которых образуют головку. В этом белковом комплексе имеется трансмембранный канал для протонов. Когда через этот канал проходят протоны из межмембранного пространства в матрикс, т.е. по своему электрохимическому градиенту, из АДФ и фосфата синтезируется АТФ.
Исходя из теории П. Митчела, образование АТФ можно разделить на 4 этапа: 1) фосфат-анион и АДФ соединяются с ферментом; 2) два протона входят в канал АТФазы и соединяются с одним из атомов кислорода фосфата, образуется вода; 3) атом кислорода АДФ соединяется с атомом фосфора, образуя АТФ; 4) АТФ отделяется от фермента.
Число протонов, необходимое для синтеза 1 молекулы АТФ, в точности не известно. Для упрощения приводимых ниже расчетов предполагают, что при прохождении через АТФазу каждых двух протонов синтезируется 1 молекула АТФ.
Поскольку процесс образования АТФ из АДФ и фосфата обратим, фермент может, используя энергию гидролиза АТФ, переносить протоны через мембрану в противоположном направлении: из матрикса в межмембранное пространство митохондрии. В каком направлении будет работать АТФ-синтетаза – фосфорилирования АДФ или гидролиза АТФ – зависит от концентрации в матриксе митохондрии АТФ, АДФ и фосфата.
Внутренняя мембрана митохондрии, как и мембраны тилакоидов хлоропласта, выполняет сопрягающую функцию, т.е. соединяет два процесса – транспорт электронов и синтез АТФ. Синтез АТФ из АДФ и неорганического фосфата сопряжен с транспортом электронов и перекачиванием протонов.
Сопряженными называют процессы, которые идут одновременно и один процесс доставляет энергию для другого. Любое нарушение, вызывающее прекращение транспорта электронов или увеличивающее проницаемость мембраны для протонов, приводит к торможению синтеза АТФ и выделению освобождающейся энергии в виде тепла.
Итак, физиологический смысл транспорта электронов заключается в возникновении электрохимического потенциала, энергия которого используется для синтеза АТФ из АДФ и неорганического фосфата.
Процесс фосфорилирования АДФ с образованием АТФ, сопряженный с транспортом электронов от восстановленных коферментов к кислороду воздуха, называют окислительным фосфорилированием.
Суммарное уравнение этого процесса можно записать так:
НАДН + Н+ + 3АДФ +3Фн + 1/2О2 → НАД+ + 3АТФ + 4Н20
При окислении каждой молекулы НАДН синтезируются три молекулы АТФ, а при окислении каждой молекулы ФАДН2 – две.
С помощью специального белка, находящегося во внутренней мембране митохондрии, образовавшиеся в результате окислительного фосфорилирования молекулы АТФ быстро выходят в цитозоль, а молекулы АДФ из цитозоля транспортируются обратно в матрикс по принципу антипорта.
Дыхательная цепь и АТФазы находятся во внутренней мембране митохондрий. АТФазы образуют грибовидные выросты мембраны.
На наружной мембране митохондрии расположены ферменты субстратного фосфорилирования и гликолиза; в матриксе митохондрии – ферменты цикла Кребса и ферменты, катализирующие окисление жирных кислот. Из расположения ферментов можно заключить, что основная функция митохондрий – превращение энергии сложных органических веществ в энергию макроэргических связей АТФ. Образующийся в результате β-окисления жирных кислот ацетил-КоА включается в ЦТК.
Мембраны митохондрий проницаемы для большей части малых молекул и ионов. Например, пируват, образующийся в цитозоле при распаде глюкозы, легко проходит в матрикс митохондрии, где в результате цикла Кребса распадается на СО2 и воду.
В клетках зеленых растений обычно меньше митохондрий, чем в животных клетках, так как синтез АТФ у первых идет и в хлоропластах, интенсивность дыхания у них тоже ниже.
В строении хлоропластов и митохондрий много общего. Так, обе органеллы окружены двойной мембраной. За счет выпячивания внутренней мембраны в матрикс или строму в митохондриях образуются кристы, а в хлоропластах – тилакоиды стромы. Обе органеллы относительно автономны: как и ядро содержат ДНК, РНК и рибосомы; как и хлоропласты, митохондрии двигаются – собираются в той части клетки, которой в данный момент нужно больше энергии. Например, при делении ядра митохондрии подходят к нему, а при поглощении солей корневым волоском – к поверхности волоска. В зеленых клетках митохондрии располагаются около хлоропластов или хлоропластов и пероксисом. На поверхности хлоропласта иногда образуются выпячивания, с помощью которых хлоропласты могут соединяться с митохондриями. Это доказывает, что в зеленых клетках фотосинтез и дыхание взаимосвязаны. И митохондрии, и хлоропласты размножаются деленим и почкованием.
Существует гипотеза, что хлоропласты – это какие-то сине-зеленые водоросли (цианобактерии), а митохондрии – примитивные бактерии, которые на заре эволюции внедрились в гетеротрофные клетки предков растений. Подтверждением этого служат следующие факты. Липиды и белки внутренней мембраны митохондрий по составу похожи на липиды и белки бактерий. Синтез белка в митохондриях и бактериях ингибируется одними и теми же антибиотиками, которые не влияют на синтез белка в других частях растительной клетки. В митохондриях содержатся плазмиды – микрокольцевые молекулы ДНК, способные к саморепликации.
3 Дыхание и обмен веществ в растительной клетке
Восстановленные при распаде дыхательного субстрата коферменты включаются в ЭТЦ, окисляются, что приводит к синтезу АТФ. При окислении НАДН, НАДФН синтезируется три, а при окислении ФАДН2 – две молекулы АТФ. Следовательно, всего при окислении молекулы глюкозы синтезируется 38 молекул АТФ: в результате гликолиза образуется 10 молекул (две расходуются на первоначальное активирование глюкозы), при окислительном карбоксилировании пирувата – шесть, в цикле Кребса – 24.
Приведенный расчет подчеркивает малую эффективность гликолиза как источника АТФ. Энергетическая эффективность гликолиза мала, так как его конечный продукт ПВК – восстановленное вещество, т. е. в нем еще остается большой запас энергии.
Зачем в таком случае гликолиз, возникший на первых этапах эволюции, сохраняется у высших растений? Это связано, во-первых, с тем, что он может действовать в качестве «аварийного» механизма в условиях временного анаэробиоза как поставщик АТФ и НАДН для клеточных биосинтезов. Во-вторых, он является источником метаболитов для синтеза веществ.

Роль дыхания в биосинтетических процессах растительной клетки
В пентозофосфатном окислительном цикле восстанавливается 12 молекул НАДФ+; в результате их окисления синтезируется 36 молекул АТФ. Если в начале цикла была потрачена одна молекула АТФ на фосфорилирование глюкозы, то общий выход составляет 35 молекул АТФ.
При работе ЭТЦ в результате поглощения одного атома кислорода могут синтезироваться три молекулы АТФ. Однако в реальной обстановке количество синтезируемых молекул АТФ может быть меньше. Последнее определяется степенью сопряжения окисления и фосфорилирования. Любые воздействия, увеличивающие проницаемость мембран для протонов или нарушающие размещение компонентов электрон-транспортной цепи, приводят к уменьшению или прекращению синтеза АТФ. В качестве показателя, характеризующего количество образованных молекул АТФ и степень сопряжения аэробного дыхания и фосфорилирования, используется соотношение Ф:О (Ф – количество молей неорганического фосфата, которое пошло на фосфорилирование АДФ, О – количество поглощенного кислорода).
При поглощении одного атома кислорода и переносе электронов от НАДН или НАДФН на кислород с образованием воды максимально могут синтезироваться три молекулы АТФ, поэтому Ф:О = 3.
Когда электроны транспортируются от ФАДН2, то Ф:0 = 2.Таким образом, величина Ф:О зависит от природы окисляемого вещества. При окислении α-кетоглутората, кроме фосфорилирования, в дыхательной цепи при окислении НАДН происходит субстратное фосфорилирование и образуется еще одна молекула АТФ, поэтому Ф: О = 4.
Зная, сколько синтезировалось молекул АТФ, можно подсчитать количество энергии, запасенной в макроэргических связях. Чем больше энергии запасается в клетке, тем лучше станет она работать, поэтому показатель Ф:О называют физиологическим показателем эффективности дыхания. При сопряжении окисления и фосфорилирования в макроэргических связях запасается 40 % энергии, которая освобождается при разрушении глюкозы в процессе гликолиза и цикле Кребса, таким образом, 60 % этой энергии выделяется в виде тепла. Когда сопряжение транспорта электронов и фосфорилирования нарушается, то еще больше энергии рассеивается в виде тепла.
Соотношение Ф:О меньше 3 в большинстве случаев указывает на нарушение сопряжения транспорта электронов с фосфорилированием. Это нарушение может быть вызвано разными причинами, например температурой. Увеличение температуры до 45 °С практически не влияет на соотношение Ф: О, но при 46-47 °С веичина Ф:О быстро падает до нуля, т.е. происходит разъединение окисления и фосфорилирования. При этих температурах разрушаются кристы митохондрий, что и является причиной разобщения и резкого снижения величины Ф:О.
В состоянии разобщения распадается дыхательный субстрат, клетка выделяет СО2, поглощает кислород, образуется вода, идет транспорт электронов, но не синтезируется АТФ. В результате вся энергия рассеивается в виде тепла. Может нарушаться и транспорт электронов по дыхательной цепи.
Величина Ф:О снижается как при обезвоживании, так и при набухании митохондрий. Вообще, при любых воздействиях, нарушающих внутреннюю мембрану митохондрий, размещение дыхательной цепи или расстояния между ними, показатель Ф:О уменьшается, так как нарушается сопряжение окисления и фосфорилирования.
В молодых тканях сопряжение этих процессов лучше, чем в старых. Вещества, увеличивающие проницаемость мембраны для протонов (например, динитрофенол), получили название дыхательных ядов. При их воздействии на клетку протоны, попавшиена наружную сторону внутренней мембраны митохондрий в результате функционирования ЭТЦ, возвращаются в матрикс органеллы, поэтому электрохимический потенциал на мембране не возникает и АТФ не синтезируется. Происходит разобщение окисления и фосфорилирования, и величина Ф:О снижается до нуля. Величина показателя Ф: О увеличивается под воздействием стимуляторов роста, например под воздействием ИУК.
Что происходит в энергетическом обмене веществ в незеленой клетке? Все процессы обмена, при которых освобождается энергия, делят на три основные фазы. На первой фазе большие молекулы органических веществ разрушаются на более мелкие: сложные углеводы преобразуются в гексозы и пентозы, белки – в аминокислоты, жиры – в глицерин и жирные кислоты. На этой фазе выделяется менее 1 % запаса энергии этих веществ.
На второй фазе сравнительно небольшие молекулы гексоз, аминокислот, глицерина и жирных кислот окисляются. Кроме воды и СО2, образуется ацетил-СоА, α-кетоглуторат и ЩУК. Ацетил-СоА образуется через пируват из гексоз и глицерина, а также из некоторых амино- и жирных кислот. Часть аминокислот преобразуется в α-кетоглуторат или ЩУК. Во время второй фазы освобождается от 15 до 30 % энергии, заключенной в этих веществах.
Ацетил-СоА, оксалоацетат и кетоглуторат полностью окисляются во время третьей фазы в результате разрушения веществ через цикл Кребса до СО2 и воды. Цикл Кребса представляет собой окончательный путь окисления всех органических веществ. Во время третьей фазы освобождается 70-80 % энергии.
В зеленых же клетках источником АТФ служит и фотосинтез. Для характеристики дыхания как физиологического процесса, кроме величины Ф:О, используют показатель интенсивности (скорость) дыхания и коэффициент дыхания. Интенсивность дыхания – это количество кислорода, поглощенного за 1 час граммом сухой (или сырой) массы растительного материала. Ее можно измерить и количеством СО2, который выделяется за 1 час одним граммом растительной массы.
При одновременном учете количества выделяющегося СО2 и поглощенного О2 определяют дыхательный коэффициент (ДК). Дыхательный коэффициент – это соотношение количества выделенного СО2 к количеству поглощенного кислорода ДК = СО2/О2.
Выявить и, особенно, измерить интенсивность дыхания зеленых частей растения на свету нелегко, так как одновременно идет и фотосинтез, в газообмене которого участвуют те же газы. По изменению газовой среды, в которой находятся листья, можно определить, какой из двух процессов в данный момент происходит с наибольшей интенсивностью. Днем, как правило, количество поглощенного СО2 для фотосинтеза больше, чем выделяется при дыхании. Дыхание на свету складывается из фотодыхания и митохондриального дыхания. При снижении скорости фотосинтеза может наступить момент, когда фотосинтез начнет компенсировать одновременно идущее дыхание и мы не сможем выявить газообмен. При дальнейшем снижении фотосинтеза дыхание начинает превалировать, а в темноте происходит только выделение СО2, который образуется при дыхании.
Интенсивность дыхания варьирует в широких пределах, от 0,02 до 715 мг СО2/г сухого вещества в час. С разной интенсивностью дышат представители разных систематических групп. Теневыносливые растения дышат менее интенсивно, чем светолюбивые. Интенсивность дыхания зависит и от особенностей органов, и их физиологического состояния. Корни дышат слабее листьев, а интенсивность дыхания цветков, наоборот, в 3–4 раза выше по сравнению с листьями.
Видовая специфика дыхания отмечена у корней древесных растений. Молодые корни лиственных древесных пород дышат интенсивнее, чем хвойных, быстрорастущих – интенсивнее медленнорастущих и теневыносливых. Очень высокая интенсивность дыхания у поглощающих корней, отличающихся повышенным обменом веществ, а также придаточных. Дыхание микоризных корней в 2–4 раза выше немикоризных.
Низкое дыхание наблюдается у сухих семян, древесины побегов, а также у зрелых плодов и клубней. У плодов, перикарпий которых состоит из сочной многослойной паренхимы, резкое повышение дыхательной активности наблюдается сначала в период деления клеток после опыления и роста завязи с последующим спадом при увеличении размеров разделившихся клеток. Перед созреванием наблюдается второй пик дыхания, связанный с качественными изменениями в биохимии плода (климактерический подъем дыхания). У яблок сорта Антоновка упомянутый подъем дыхания сохраняется и после сбора плодов при хранении примерно в течение месяца, затем процесс дыхания стабилизируется. Интенсивность дыхания зависит и от сексуализации растений: дыхание листьев мужских экземпляров сосны оказалось в 1,5–2 раза выше, чем женских.
С возрастом интенсивность процесса дыхания также не остается одинаковой. Наиболее интенсивно дышат только что распустившиеся молодые листья, а менее всего – старые листья. Эта закономерность сохраняется и для облиственного побега в целом. Подобная картина наблюдается и у древесных, как лиственных, так и хвойных пород.
Так, листья 4–6-дневного возраста у дуба черешчатого дышат в 2 раза интенсивнее по сравнению с полностью сформировавшимися листьями. Наиболее интенсивно протекает дыхание у хвои текущего года, а затем оно замедляется. Так, дыхание 3-летней хвои ели обыкновенной в 4 раза слабее дыхания хвои текущего года. Дыхание побегов разного возраста также различно: интенсивность этого процесса у побегов дуба черешчатого диаметром 3 см значительно ниже, чем диаметром 0,5 см. Обусловливается это наличием, в молодых побегах большего числа активно функционирующих тканей, высокое дыхание побегов наблюдается лишь в период вегетации, тогда как корней – почти в течение всего года.
Дыхание обнаруживается и в стволе срубленного дерева. Здесь интенсивность этого процесса достигает наибольших величин в лубе, а в заболони последних трех-четырех годичных слоев она в 4–11 раз ниже.
Дыхание наблюдается во всех живых клетках, в любое время дня и ночи, в период активного роста дерева и в состоянии покоя. Поэтому существенная часть синтезированных в процессе фотосинтеза ассимилятов потребляется на дыхание. В среднем отношение фотосинтеза к темновому дыханию составляет у молодых листьев 1,5–2 и увеличивается до 4–5,5 у более зрелых. Вместе с тем у однолетней хвои сосны в течение теплого п