Цель работы: определить общее содержание в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями.
Теоретическая часть
Теоретическим значением химического потребления кислорода (ХПК) называют количество кислорода (или окислителя в расчёте на кислород в мг/дм3, необходимое для полного окисления содержащихся в пробе органических веществ. При этом углерод, водород, сера, фосфор и другие элементы (кроме азота), если они содержатся в органическом веществе окисляются до СО2, Н2О, Р2О5, SO3, а азот превращается в аммонийную соль. Кислород, входивший в состав окисляемых органических веществ, участвует в процессе окисления, а водород этих соединений отдаёт по 3 атома на каждый атом азота при образовании аммонийной соли.
Практически применяемые методы определения ХПК дают результаты, очень близкие к теоретическому ХПК, но могут отклоняться в зависимости от метода определения в ту или иную сторону. Если окисление органических веществ прошло не полностью, то результат получится заниженным. Кроме того, при любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, если они были в пробе. В том случае содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Для определения ХПК имеются «сухие» методы, в которых органические вещества пробы сжигаются в токе кислорода или углекислого газа, и «мокрые» методы – окисление пробы персульфатом аммония, перманганатом, бихроматом калия и т.п.
Из всех предложенных в разное время окислителей наиболее эффективным и удобным в применении оказался бихромат калия в присутствии серной кислоты (18N). Бихромат при этом восстанавливается согласно уравнению:
Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O.
Окисление органических веществ бихроматом в условиях ускоряется и охватывает практически все органические вещества, если в качестве катализатора вводить в реакционную смесь сульфат серебра и идёт до образования двуокиси углерода и воды, азот выделяется в виде газа.
Общее количество восстановителей пропорционалъно бихромату калия, который оттитровывают солью Мора в присутствии индикатора N-фенилантраниловой кислоты.
Мешающее влияние хлоридов при содержании выше 25 мг/дм3 устраняют маскированием их сульфатом ртути (II) в количестве 22,2 мг HgSO4 на 1 мг СL. Образующийся очень мало диссоциированный хлорид ртути (II) достаточно устойчив даже в присутствии большой концентрации серной кислоты и бихромата калия.
При анализе сточных вод, прошедших биологическую очистку, для устранения мешающего влияния нитритов прибавляют 10 мг сульфаминовой кислоты на 3 мг NО2. При кипячении раствора нитрит-ионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
H2NSO2OH + HNO2 = N2 + H2SO4 + H2O
H2NSO2OH + H2O = NH4HSO4
Ход работы:
Отбирают 50 см3 анализируемой пробы и переносят в круглодонную колбу вместимостью 300 см3. Прибавляют 1 г сульфата ртути (II), 5 см3 серной кислоты, перемешивают до растворения сульфата ртути, затем вливают 25 см3 стандартного раствора бихромата калия, очень осторожно, малыми порциями вливают 70 см3 серной кислоты, всыпают 0,4-0,5 г сульфата серебра, вводят в колбу несколько «кипелок», закрывают пробкой, соединенной с обратным холодильником, и нагревают до слабого кипения, которое поддерживают 30-60 минут. Затем охлаждают, обмывая стенки холодильника 25 см3 дистиллированной воды, и переносят содержимое этой колбы в коническую колбу вместимостью 500 см3, обмывая стенки первой колбы несколько раз дистиллированной водой. Добавив дистиллированную воду до объема 350 см3, вводят 10-15 капель раствора N-фенилантраниловой кислоты (3-4 капли раствора ферроина) и оттитровывают избыток бихромата титрованным раствором соли Мора.
Проводят холостой опыт, для этого берут 50 см3 дистиллированной воды и проводят через все ступени анализа.
Вывод: Химическое поглощение кислорода, выраженное числом мг кислорода на 1 дм3 сточной воды, вычисляют по формуле:
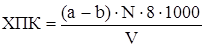 ,
,
где а – объем раствора соли мора {FeSO4·(NH4)2SO4·6H2O};
b – объем раствора соли Мора, израсходованного на титрование анализируемой пробы, см3;
N – нормальность титрованного раствора соли Мора;
8 – эквивалент кислорода.
Контрольные вопросы:
1. Понятие теоретического и химического потребления кислорода.
2. Методы определения ХПК.
3. Почему и как необходимо устранять хлорид-ионы при анализе проб сточной воды?
4. Как можно определить общее содержание восстановителей в анализируемой пробе?