ФИЗИКА, ГРУППА № 34, 11.11.2021 г.
Занятие № 34
Тема: Строение атома. Опыты Резерфорда.
Цель: изучить понятие атомное ядро, опыты Резерфорда, планетарная модель строения атома; модели атома Томсона и Резерфорда.
План:
1. Модель Томсона.
2. Опыты Резерфорда.
3. Планетарная модель атома.
Теоретический материал для самостоятельного изучения
Модель Томсона.
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица.
Масса покоя электрона me = 9,1·10-31кг.
По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели - «Пудинг с изюмом».
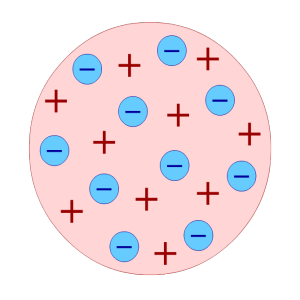
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Опыты Резерфорда.
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Альфа-частицы (α-частицы) – это ионизированные атомы гелия, положительно заряженная частица, положительный заряд гелия в два раза больше заряда электрона.
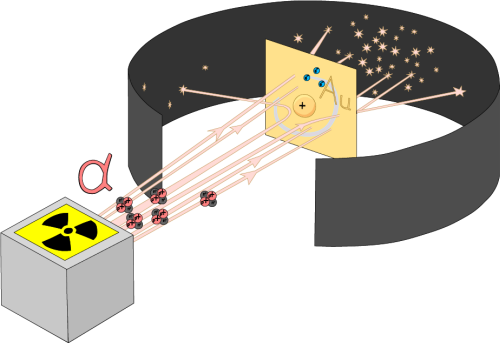
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. В опытах Резерфорда были использованы α-частицы, имеющие кинетическую энергию в 5 Мэв. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
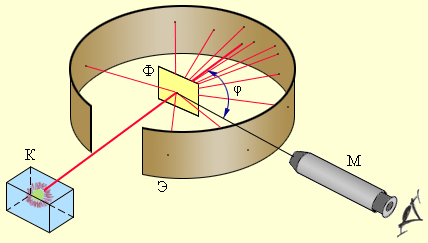
Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи).
Отсюда можно сделать вывод: такое поведение α-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряжённым телом малых по сравнению с атомом размеров.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны).
Размер атома: примерно 10-8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома.
На основе своих опытов Резерфорд создал планетарную модель атома.
Опыты Резерфорда приводили к радикальным выводам и сомнениям ученых. Используя классическое представление о движении микрочастиц, он предлагает планетарную модель атома. Ее смысл заключался в том, что центр атома состоит из положительно заряженного ядра, которое является основной частью массы элементарной частицы. Атом считается нейтральным. При наличии кулоновских сил вокруг ядра по орбиталям вращаются электроны. Электроны всегда находятся в состоянии движения.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
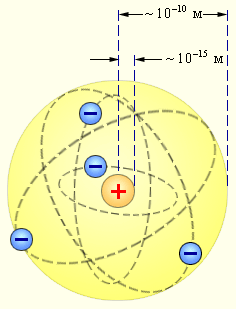
Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Закон Кулона:

Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Число электронов в нейтральном атоме равно порядковому номеру Z элемента в периодической системе Д.И. Менделеева. Заряд атомного ядра q равен произведению Z и заряда электрона е:
q= Z • е.
Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона.
Простейший атом — атом водорода.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Атом водорода:
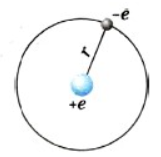
В атоме водорода вокруг ядра обращается всего лишь один электрон.
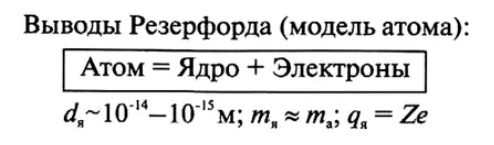
Основная литература по теме урока:
1) Учебник «Физика 11» Г.Я. Мякишев, Б.Б. Буховцев, М. «Просвещение»
2) интернет ресурсы
Домашнее задание: изучить материал, сделать краткий конспект.
Задание скидывать в группу
Гр. https://vk.com/club194181059