Набухание ионитов
Набуханием называется процесс постепенного увеличения объема ионита, помещенного в жидкий растворитель, за счет проникновения молекул растворителя вглубь углеводородного каркаса. Чем сильнее набухает ионит, тем быстрее идет обмен ионами. Набухание характеризуется весовым набуханием - количеством поглощенной воды на 1 г сухого ионита или коэффициентом набухания - отношением удельных объемов набухшего ионита и сухого. Нередко, объем смолы в процессе набухания может увеличиться в 10-15 раз. Набухание высокомолекулярной смолы тем больше, чем меньше степень сшивки образующих ее звеньев, то есть чем менее жесткая у нее макромолекулярная сетка. Большинство стандартных ионитов содержит в сополимерах 6-10% дивинилбензола (иногда 20%). При использовании для сшивки вместо дивинилбензола длинноцепочечных агентов получают хорошо проницаемые макросетчатые иониты, на которых ионный обмен идет с большой скоростью. Помимо структуры матрицы на набухание ионита влияет наличие в нем гидрофильных функциональных групп: ионит набухает тем сильнее, чем больше гидрофильных групп. Кроме того, сильнее набухают иониты, содержащие однозарядные противоионы, в отличие от двух- и трехзарядных В концентрированных растворах набухание происходит в меньшей степени, чем в разбавленных. Большинство неорганических ионитов совсем или почти не набухают, хотя и поглощают воду.
Емкость ионитов
Ионообменная способность сорбентов характеризуется их обменной емкостью, зависящей от числа функциональных ионогенных групп в единице массы или объема ионита. Она выражается в миллиэквивалентах на 1 г сухого ионита или в эквивалентах на 1м3 ионита и для большинства промышленных ионитов находится в пределах 2-10 мэкв/г. Полная обменная емкость (ПОЕ) – максимальное количество ионов, которое может быть поглощено ионитом при его насыщении. Это постоянная величина для данного ионита, которую можно определить как в статических, так и в динамических условиях.
В статических условиях, при контакте с определенным объемом раствора электролита, определяют полную статическую обменную емкость (ПСОЕ), и равновесную статическую обменную емкость (РСОЕ), которая изменяется в зависимости от факторов, влияющих на равновесие (объем раствора, его состав, концентрация и др.). Равновесие ионит – раствор соответствует равенству их химических потенциалов.
В динамических условиях, при непрерывной фильтрации раствора через определенное количество ионита определяют динамическую обменную емкость – количество ионов, поглощенных ионитом до проскока сорбируемых ионов (ДОЕ), полную динамическую обменную емкость до полной отработки ионита (ПДОЕ). Емкость до проскока (рабочая емкость), определяется не только свойствами ионита, а также зависит от состава исходного раствора, скорости его пропускания через слой ионита, от высоты (длины) слоя ионита, степени его регенерации и величины зерен.
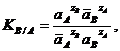 |
Обычно ДОЕ превышает 50% от ПДОЕ для сильнокислых и сильноосновных ионитов и 80% для слабокислых и слабоосновных ионитов. Емкость сильнокислых и сильноосновных ионитов остается практически неизменной в широком диапазоне рН растворов. Емкость же слабокислых и слабоосновных ионитов в значительной степени зависит от рН.
 |
Степень использования обменной емкости ионита зависит от размеров и формы зерен. Обычно размеры зерен находятся в пределах 0,5-1 мм. Форма зерен зависит от способа приготовления ионита. Они могут быть сферическими или иметь неправильную форму. Сферические зерна предпочтительнее – они обеспечивают лучшую гидродинамическую обстановку и большую скорость процесса. Применяют также иониты с цилиндрическими зернами, волокнистые и другие. Чем мельче зерна, тем лучше используется обменная емкость ионита, но при этом в зависимости от применяемой аппаратуры, возрастает или гидравлическое сопротивление слоя сорбента, или унос малых зерен ионита раствором. Уноса можно избежать применяя иониты, содержащие ферромагнитную добавку. Это позволяет удерживать мелкозернистый материал во взвешенном состоянии в зоне – магнитного поля, через которую движется раствор.
Иониты должны обладать механической прочностью и химической устойчивостью, то есть не разрушаться в результате набухания и работы в водных растворах. Кроме того, они должны легко регенерироваться, тем самым сохранять свои активные свойства в течение длительного времени и работать без смены несколько лет.
РАВНОВЕСИЕ ИОННОГО ОБМЕНА
Ионный обмен, как любая химическая реакция, подчиняется общим термодинамическим законам равновесия. Проникновение воды в зерно ионита вызывает диссоциацию ионогенных групп, которая меньше, чем в растворе, однако достаточна для того, чтобы ион мог свободно диффундировать, поэтому матрицу можно рассматривать как аналог иона в растворе электролита. Таким образом, при контакте раствора электролита с ионитом происходит ионный обмен, который протекает до достижения равновесия. Реакция протекает обратимо в эквивалентных соотношениях. В общем виде реакция обмена ионов А и В описывается уравнением
RA + BX «RB + AX,
или в ионном виде с учетом заряда ионов
Для этой реакции по закону действующих масс константа термодинамического равновесия выражается следующим образом:
(3.5.2)
где āА, āВ и аА, аВ - активности ионов в ионите и растворе.
Сведения о коэффициентах активностей ионов в многокомпонентных растворах весьма ограничены, а методы определения коэффициентов активностей ионов в составе набухших ионитов пока вообще отсутствуют. Поэтому термодинамическую константу используют при теоретическом обсуждении ионообменного равновесия. Для расчета ионообменных равновесий на практике пользуются кажущейся (концентрационной) константой, полученной по экспериментальным данным, ее называют также константой обмена:
 |
(3.5.3)

где ĊА, ĊВ и СА, СВ - молярные концентрации ионов в ионите и растворе.
Численное значение концентрационной константы зависит от единиц, в которых выражены концентрации. Эта константа является безразмерной величиной при выражении равновесных концентраций в молярных долях или для реакций между ионами с одинаковыми зарядами независимо от выбора единиц концентраций.
Для описания состояния равновесия кроме констант ионного обмена на практике применяют коэффициент распределения D и коэффициент разделения (селективности, избирательности) ТВ/А.
Коэффициент распределения равен отношению концентраций обмениваемых ионов в ионите и в растворе
Коэффициент разделения равен отношению коэффициентов распределения обмениваемых ионов:
 |
(3.5.5)
При равных зарядах обмениваемых ионов концентрационная константа равновесия и коэффициент разделения равны, а при обмене разнозарядных ионов они могут существенно различаться. Селективность - важное свойство ионита, характеризующее его способность к разделению ионов и способность селективно поглощать отдельные ионы или группы ионов из их смеси. Некоторые иониты проявляют высокую избирательность по отношению к какому-либо одному иону по сравнению с многими другими. В этом случае говорят о специфичности ионита, которая связана с особенностями чисто химического взаимодействия ионита с ионом.
При ТВ/А >1 ионит селективен к иону В по сравнению с ионом А, а при ТВ/А <1 избирательно сорбируется ион А. Если коэффициент селективности равен единице, то ионит не избирателен ни к одному из ионов и их разделить нельзя. С точки зрения термодинамики ионит будет селективен по отношению к иону В по сравнению с ионом А в том случае, если разность изменения энергии Гиббса при переходе ионов В и А из внешнего раствора в ионит меньше нуля:
Изменение энергии Гиббса при переходе ионов из внешнего раствора во внутренний определяется двумя основными факторами: различием энергии гидратации ионов и энергией электростатического взаимодействия их с ионами противоположного знака (фиксированными ионами во внутреннем растворе, к ионами во внешнем растворе). На основании сопоставления этих величин и общего изменения энергии Гиббса при переходе ионов из внешнего раствора во внутренний предложены ряды селективности для катионитов и анионитов. При составлении рядов учитывается, что электростатическое взаимодействие между ионами во внутреннем электролите выражено в большей степени, чем во внешнем растворе. Это обусловлено меньшей степенью гидратации ионов в концентрированном растворе фазы ионита, меньшим средним расстоянием между ионами и более низким значением диэлектрической проницаемости.