ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Пример 1. Какую валентность, обусловленную неспаренными электро- нами (спин-валентность), может проявлять фосфор в нормальном и возбужден- ном (*) состояниях?
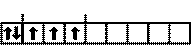 Решение. Распределение электронов внешнего энергетического уровня фосфора,...3s2 Зр 3 (учитывая правило Хунда, 3 s 2 ЗрхЗруЗрz) по квантовым ячей- кам имеет вид:
Решение. Распределение электронов внешнего энергетического уровня фосфора,...3s2 Зр 3 (учитывая правило Хунда, 3 s 2 ЗрхЗруЗрz) по квантовым ячей- кам имеет вид:
15P
3 s 23 px 3 py 3 pz
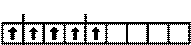 Атомы фосфора имеют свободные d -орбитали, поэтому возможен переход од- ного 3 s -электрона в 3 d -состояние:
Атомы фосфора имеют свободные d -орбитали, поэтому возможен переход од- ного 3 s -электрона в 3 d -состояние:
15P*
3 s 3 px 3 py 3 pz 3 dxy
Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном – пяти.
Пример 2. Что такое гибридизация валентных орбиталей? Какое строе- ние имеют молекулы типа АВn если связь в них образуется за счет sp-, sp 2 -, sp 3 - гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образо- вании ковалентных связей не только "чистых" АО, но и "смешанных", так называемых гибридных, АО. При гибридизации первоначальная форма и энер- гия орбиталей (электронных облаков) взаимно изменяются и образуются орби- тали (облака) новой одинаковой формы и одинаковой энергии. Число гибрид-
ных орбиталей (q) равно числу исходных. Ответ на поставленный вопрос отра- жен в табл. 4.
Таблица 4
Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные ор- битали атома А | Тип гибриди- зации | Число гибрид- ных орбиталей атома А | Пространственная конфигурация моле- кулы |
| АВ2 | s + p | sp | Линейная | |
| АВ3 | s + p + p | sp 2 | Треугольная | |
| АВ4 | s + p + p + p | sp 3 | Тетраэдрическая |
Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов, второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую
|
прочность связей в молекулярных ионах 2 и
+
|
N +
лекулах F2 и O2; наоборот, меньшую прочность связи в ионе 2, чем а молеку-
He +
ле N2; существование молекулярного иона 2 и неустойчивость молекулы
Нe2 и т.п.). Более плодотворным оказался другой подход к объяснению кова- лентной связи – метод молекулярных орбита-лей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбита- лей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способ- ствует образованию химической связи и называется связывающей. Молекуляр- ной орбитали, образовавшейся от вычитания атомных, соответствует более вы- сокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие свя- зывающие и разрыхляющие орбитали, называют соответственно связывающи- ми (св) и разрыхляющими (разр) электронами. Заполнение молекулярных орби- талей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
|
|
= p св 2 p
<p разр 2 p
=p разр 2 p
<p разр 2 p
|
|
|
|
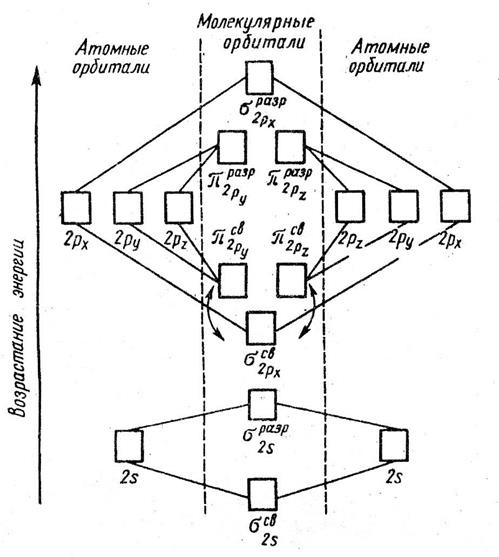
Рис. 2. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Следует отметить, что при образовании молекул В2, С2 и N2 энергия свя- зывающей s2 px -орбитали больше энергии связывающих p2 py - и p2 pz -орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих p2 py - и p2 pz - орбиталей больше энергии связывающей s2 px -орбитали. Это нужно учитывать при изображении энергетических схем (рис. 2) соответствующих молекул.
Порядок связи в молекуле определяется разностью между числом связы- вающих и разрыхляющих орбиталей, деленный на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положитель- ному числу.
Подобно электронным формулам, показывающим распределение электро- нов в атоме по атомным орбиталям, в методе МО составляются формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначаются греческими буквами s p d j.
Так, электронная конфигурация молекул О2 описывается следующим образом:
О [ KK (s св)2(s разр)2(s pсв)2(p pсв)2(p pсв)2p pразр p p разр ].
2 s s x y z y z
Буквами КК показано, что четыре 1 s -электрона (два связывающих и два раз- рыхляющих) практически не оказывают влияния на химическую связь.