Введение
Выбранная тема данной курсовой работы отвечает современным проблемам, существующим в области химического образования.
ПЕРОКСИДЫ- соединения, содержащие группировку - О-О-, т.е. производные пероксида водорода Н2О2. Характерной чертой химической структуры перекисей является присутствие двух молекул кислорода, соединенных посредством простой ковалентной связи (пероксиды соединения). Эта структура отличается нестабильностью. Перекиси легко распадаются на высоко реактивные свободные радикалы. Отрицательно заряженный ион перекиси служит в качестве инициатора многих химических реакций. Эта реакционная способность является ключом к широкому применению некоторых перекисей в промышленности и также к опасностям, которые они могут представлять для людей и окружающей среды.
Барий - элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 56. Барий (хим. обозн. Ва, атомный вес 137) принадлежит к группе щелочноземельных металлов и по своим свойствам в особенности близок к кальцию и стронцию. Металлическая природа его доказана Берцелиусом, получившим амальгаму бария, из которой Дэви в 1808 году выделил и самый металл. В природе в свободном состоянии Б. никогда не встречается, но в виде соединений он довольно распространен в минеральном царстве.
Пероксид бария - химическое соединение бария с кислородом, имеющее химическую формулу BaO2. Соединение представляет собой белый или темно-серый порошок, плохо растворимый в воде. С водой образует кристаллогидраты BaO2•8H2O и BaO2•H2O.
Строение пероксида бария
пероксид барий химический воздействие
Пероксид бария - это химическое соединение бария с кислородом, имеющее химическую формулу ВаО2. Является производной пероксида водорода.
Необходимо обратить внимание на следующее. Перекись бария ВаО2 и, например, оксид свинца (IV) РЬО2 имеют одинаковые брутто-формулы. Поэтому, несмотря на одинаковые брутто-формулы, строение перекисей и оксидов различно. Кристаллографическое изучение пероксидов щелочных металлов (ВаО2) показало, что эти кристаллы содержат ион О22-, в котором длина связи О - О равна 1.49 А (одинарная связь). Барий образует ионный пероксид.
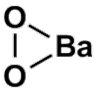 - структурная формула.
- структурная формула.
O=Pb=O - структурная формула
Свойства соединения
Физико-химические свойства:
Перекись бария BaO2 - белый порошок с плотностью 4.96 г./см³, весьма устойчивый в сухом виде, довольно трудно растворимый в воде порошок, совершенно нерастворимый в спирте и эфире. При температуре около 800°С реактив теряет половину кислорода и переходит в BaO. Технический продукт содержит 80-90% BaO2 и окрашен соединениями железа в желтоватый или зеленоватый цвет. Перекись бария обладает парамагнитными свойствами. При нагревании с углем действует как деполяризатор, при этом протекает реакция:
BaO2 + C = 2BaO + CO2
С водой пероксид бария дает гидрат ВаО2∙8Н2О; с Н2О2 также дает соединение ВаО2∙Н2О2. Водный раствор пероксида бария действует на соли двухвалентного железа как окислитель, а на гексацианоферрат (ІІІ) калия К3(Fе(СN)6] и также на многие другие соли тяжелых металлов, наоборот, как восстановитель. Так, с хлоридом ртути (сулемой) она реагирует по уравнению:
HgCl2 + BaO2 = Hg + BaCl2 + O2
Элемент BaO2 - развивает электродвижущую силу, равную 1В. При нагревании выше 700С ВаО2 переходит в тестообразную массу и разлагается по обратимой реакции: 2ВаО2 ↔ 2ВаО + О2 - 34.2 ккал. Эта реакция ускоряется в присутствие влаги, гидроокиси бария и других веществ.
Многочисленные литературные данные о давлении диссоциации ВаО2 при разных температурах весьма противоречивы. Вероятно, равновесное давление кислорода равно 1 ат приблизительно при 840С.
Перекись бария является сильным окислителем. Она окисляет SO2 в сульфат (на холоду), N2O и NO в нитрат (при нагревании), разлагает сухой хлористый водород с выделением Cl2, Cl2O и даже О3. Окисление органических веществ может сопровождаться взрывом и воспламенением. С водой ВаО2 образует сначала ВаО2*8Н2О, затем Ва(ОН) 2 и Н2О2.
При действии разведенных кислот на пероксид бария образуется пероксид водорода, производной которого является пероксид бария. Пероксид водорода, как очень слабая кислота, вытесняется из своих солей более сильными кислотами:
2 + 2H+ = Ba2+ + H2O2
При нагревании выше 500 ºC в вакууме или выше 700°C на воздухе пероксид бария отщепляет кислород:
ВаО2 = ВаО + 1/2О2
Химические свойства
Взаимодействует с серной кислотой, образует нерастворимый сульфат бария и пероксид водорода:
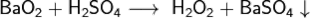
При нагревании свыше 500°C разлагается:
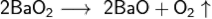
При нагревании в избытке кислорода под высоким давлением получают надпероксид бария BaO4 - неустойчивое (разлагается свыше 50°C) жёлтое вещество, которое легко разлагается в воде с выделением кислорода:
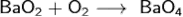
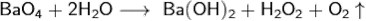
При нагревании с озоном в атмосфере фреона образуется озонид бария BaO6.
С концентрированной соляной кислотой перекись бария реагирует, выделяя хлор:
ВаO2 + 4НС1конц. = BaCl2 + Cl2 + 2H2O
Перекись бария восстанавливает соли благородных металлов (обладающие малой химической активностью) до соответствующего металла. Перекись бария применяют для получения перекиси водорода, в зажигательных бомбах, а также в качестве катализатора крекинг-процесса.
Контакт с водой может привести к температуре и концентрации кислорода достаточно высоко, чтобы зажечь органических материалов [Bretherick, в 5-е изд., 1995, с. 94]. Реагирует бурно с уксусным ангидридом в связи с образованием ацетил пероксид [Руст, 1948, с. 337].Зажигает при смешивании с порошкообразным алюминием, порошкообразный магний или кальций-кремниевых сплавов. Дерево может воспламениться с трением с перекисью. Разлагается при нагревании до 700° C для получения оксида бария и чистого кислорода [Сакс, 9-е изд., 1996, с. 317]. Формы высокой реакционной смеси с топливом типа материалов.
Идентификация продукта
Идентификация - (от ср.-век. лат. identifico - отождествляю) В химии - установление тождества неизвестного химического соединения с известным, путем сравнения их физических и химических свойств.
. Перекись бария можно получить при взаимодействии хлористого бария и перекиси водорода:
ВаСl2 + Н2О2 + 2NH4OH = ВаО2 +2NH4Cl + 2Н2О
В раствор 100 г. ВаСl2*2Н2О в 250 мл воды вносят 250 мл 30%-ной Н2О2. Затем при перемешивании приливают 200 мл NH4OH (плотность 0,91). Дают смеси отстояться, после чего жидкость сливают. Осадок ВаО2*8Н2О декантируют 2-3 раза холодной водой, отсасывают на воронке Бюхнера и тщательно промывают (рекомендуется чередовать промывание на фильтре и декантацию). Промытый осадок сушат в фарфоровой чашке при 50-70С, изредка растирая его шпателем. Когда содержимое чашки превратится в рассыпчатую массу, повышают температуру до 75-80°С. Высушенный препарат растирают в ступке и помещают в банку с притертой пробкой. Выход 55-60 г. препарата, содержащего 96% ВаО2. Чистота препарата зависит от качества исходных продуктов и степени промывания. Обычно получают ВаО2 квалификации ч.д.а. или ч.
. Наиболее чистый препарат ВаО2*8Н2О можно получить из гидроокиси бария и перекиси водорода:
Ва(ОН) 2 + Н2О2 = ВаО2 + 2Н2О
Растворяют 8 г Ва(ОН) 2*8Н2О (х. ч.) в 340 мл воды, свободной от СО2 (для получения такой воды дистиллированную воду кипятят продолжительное время и охлаждают в токе воздуха, свободного от СО2). Раствор охлаждают до 0°С и обрабатывают 10 мл 30%-ной Н2О2. Полученный белый блестящий чешуйчатый порошок ВаО2*8Н2О промывают 50 раз небольшими порциями воды, свободной от СО2. Выход около 1,5 г (15-20%). При использовании химически чистых исходных веществ и при работе в специальном приборе *2, позволяющем проводить все операции в отсутствие CO2, удается получить препарат, содержащий после обезвоживания (см. п. 1) 99% BaO2.
1. Продукт - порошок белого цвета. Октагидрат пероксида бария - белый блестящий чешуйчатый порошок.
2. Качественная реакция на пероксид-ион: к небольшому количеству продукта прилить разбавленной соляной кислоты и в полученном растворе обнаружить с помощью иодида калия наличие пероксида водорода.
BaO2 + 2HCl(разб.) = H2O2 + BaCl2; 2KI + H2O2 = I2 + KOH
3. Качественная реакция на катион бария: небольшое количество продукта добавить к 1-2 мл 2Н раствора серной кислоты. Наблюдать образование белого осадка сульфата бария.
BaO2 + H2SO4 = BaSO4↓+ H2O2
Способы получения продукта
1. Нагревание оксида бария BaO в среде кислорода при 500°C:
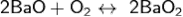
2. Сильное прокаливание Ba(NO3)2, BaCO3 или Ba(OH)2 в токе воздуха в присутствии следов воды.
. Получают, сильно прокаливая гидроокись, нитрат или карбонат бария в токе воздуха в присутствии следов воды.
Ва + 2O2 = 2ВаО + ВаO2 (до 500° С, сгорание на воздухе),
Ва(OH)2 + H2O2(конц.) = ВаO2↓ + 2H2O (0° С).
Мr = 169,33; d = 4,96; tпл = 450° С(р); ks = 0,168(20).
BaO2·8H2O = ВаO2 + 8H2O (100° С, вак.)
Технический ВаО2 получают нагреванием пористого оксида бария до температуры около 500°С в струе воздуха. При этой температуре давление кислорода над ВаО2 еще настолько незначительно, что оксид бария переходит на воздухе в пероксид.
Применение
Пероксид бария применяют для беления шелка, растительных волокон и соломы, а также - в больших масштабах - для получения пероксида водорода. Его используют для приготовления перкарбоната бария, для обесцвечивания свинцовых стекол и, кроме того, в качестве дезинфицирующего средства. Применяемые в алюмотермии запальные шарики состоят из смеси пероксида бария и магниевого порошка. Также используется для лабораторного получения пероксида водорода; как источник чистого O2; компонент пиротехнических составов; отбеливатель для ткани, бумаги.
Виды воздействий диоксида бария и оказание первой помощи
| Виды воздействия\ опасности | Острая опасность\ симптомы | Предупреждение | Первая помощь\ ликвидация пожара |
| Пожарная опасность | Негорюче, но способствует возгоранию других веществ. | Не допускать контакта с горючими веществами, восстановителями и кислотами. | В случаях возгорания в окрестностях: разрешены все виды пожаротушения. |
| Взрывоопасность | Риск пожара и взрыва при контакте с горючими веществами и восстановителями. | ||
| Воздействие | НЕ ДОПУСКАТЬ РАССЕИВАНИЯ ПЫЛИ! СТРОГИЕ МЕРЫГИГИЕНЫ! | ||
| Вдыхание | Ощущение жжения. Кашель. Затрудненное дыхание. Отдышка. Боли в горле (см. проглатывание) | Местная вытяжная вентиляция или защита органов дыхания. | Свежий воздух, покой. Полу сидячее положение. Искусственное дыхание по показаниям. Обратиться за медицинской помощью. |
| Кожа | Покраснения. Ожоги кожи. Боль. | Защитные перчатки. Защитная одежда. | Сначала промыть небольшим кол-вом воды, затем удалить загрязненную одежду и снова помыть. |
| Глаза | Покраснение. Боль. Неясность зрения. | Защитные очки-маска, или защитная маска или, если вещество в виде порошка, то защита глаз в сочетании с защитой органов дыхания. | Вначале промыть небольшим кол-вом воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу |
| Проглатывание | Боль в животе. Рвота. Понос. | Не принимать пищу, не пить и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту! Обратиться за медицинской помощью. |
| Ликвидация утечек | Хранение |
| Смести просыпанное вещество в контейнеры, затем удалить в безопасное место. НЕ засыпать древесными опилками или другими горючими абсорбентами. НЕ допускайте попадания этого химического вещества в окружающую среду (дополнительная индивидуальная защита: фильтрующийся респиратор Р2 для вредных частиц). | Отдельно от горючих веществ и восстановителей, пищевых продуктов и кормов. В сухом месте. |
Заключение
В заключение хотелось бы отметить все особенности соединения пероксида бария. При обработке литературы, связанной с данной темой, для себя я узнала очень много нового. Диоксид бария опасно влияет на органы чувств у человека, но с другой стороны, он помогает нам отбеливать бумагу и ткани. Из него очень легко получить пероксид водорода, который помогает нам обработать открытые раны и царапины.
Литература
пероксид барий химический воздействие
1. Основы неорганической химии Коттон Ф., Уилкинсон Дж, 1979
2. Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 55
3. Технология минеральных солей (удобрений, пестицидов, промышленных солей, оксидов и кислот) часть 1, издание 4 - Л.: «Химия», 1974. - 792 с.
. https://studuck.ru/documents/barii-svoistva-poluchenie-rasprostranenie