Сегодня мы разберём такие понятия, как излучение и поглощение света атомами определённого химического элемента.
Для начала введём понятие оптического спектра.
Оптическим спектром называется совокупность частот или длин волн, содержащихся в излучении какого-либо вещества.
Все оптические спектры делятся на три типа: сплошные, полосатые и линейчатые.
Спектр называется сплошным (непрерывным), если он содержит волны всех частот, плавно переходящие одна в другую. Непрерывные спектры испускают тела, находящиеся в твёрдом и жидком агрегатных состояниях, а также в состоянии сильно сжатого газа и высокотемпературная плазма. Для получения непрерывного спектра тело необходимо нагреть до определённой температуры. Характер непрерывных спектров в сильной степени зависит от взаимодействия излучающих атомов друг с другом.
Полосатым называется спектр, состоящий из отдельных полос, разделённых тёмными промежутками. Полосатые спектры состоят из молекул, находящихся в изолированном состоянии. При большом увеличении видно, что тёмные промежутки состоят из большого количества отдельных тёмных линий, близко расположенных друг к другу.
Изолированнымсостоянием атомов или молекул называется такое состояние, при котором взаимодействие между этими атомами или молекулами пренебрежимо мало.
Линейчатым называется спектр, в котором атомы излучающих химических элементов дают наборы отдельных линий определённых длин волн. Линейчатые спектры получают от газов и паров малой плотности. Для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом. При увеличении плотности атомарного газа отдельные спектральные линии расширяются, и, наконец, при очень большом сжатии газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Также бывают спектры испускания и спектры поглощения. Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого находятся в невозбуждённом состоянии.
Механизм излучения и поглощения света зависит от взаимодействия электронов в атоме, а точнее от их энергии.
Энергия электрона в атоме складывается из его кинетической энергии и потенциальной энергии взаимодействия его с ядром:

где  – коэффициент пропорциональности в законе Кулона;
– коэффициент пропорциональности в законе Кулона;
 – электрическая постоянная;
– электрическая постоянная;
 – масса покоя электрона;
– масса покоя электрона;
 – элементарный электрический заряд;
– элементарный электрический заряд;
 – скорость движения электрона.
– скорость движения электрона.
Нуль потенциальной энергии электрона выбран на бесконечном удалении от ядра; знак «–» соответствует энергии притяжения отрицательных и положительных зарядов.
Из курса химии восьмого класса Вы, знаете, что электроны в атоме располагаются по электронным орбитам (или по-научному энергетическим уровням). Так вот, энергетическим уровнем атома называется такое значение энергии, которой обладает атом, находящийся в определённом стационарном состоянии. А стационарным состоянием называется состояние атома, находясь в котором, атом не излучает и не поглощает квантов электромагнитного излучения. Теперь Вы знаете Первый постулат Нильса Бора, основоположника квантовой механики как науки (1913). К слову сказать, квантовая механика – это теория того, что свет излучается атомами вещества.
Рассмотрим атом водорода. Здесь и орбиталь-то всего одна. Электрон движется по круговой орбите вокруг положительно заряженного ядра, следовательно, обладает так называемым орбитальным моментом импульса, l. Но момент импульса электрона в атоме водорода квантован, т. е. дискретен, тогда справедлива формула:

где r – радиус электронной орбитали – кратчайшее расстояние от ядра в атоме до электрона;
 – приведённая постоянная Планка.
– приведённая постоянная Планка.
Понять механизм движения электрона в атоме нам поможет правило квантования орбит Н. Бора: на длине окружности каждой стационарной орбиты укладывается целое число n длин волн де Бройля 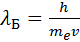 , соответствующих движению электрона:
, соответствующих движению электрона:

Если сравнить движение электрона по орбите с механическими колебаниями гитарной струны, то по аналогии с правилом квантования орбит Н. Бора определяется число мод колебаний на струне.
Кроме движения вокруг ядра электрон вращается ещё и вокруг собственной оси, здесь уже работает спиновое квантовое число, ms. Электрон обладает полуцелым спином  Являясь вращающейся вокруг своей оси заряженной частицей, электрон создаёт собственной магнитное поле (магнитное квантовое число, ml).
Являясь вращающейся вокруг своей оси заряженной частицей, электрон создаёт собственной магнитное поле (магнитное квантовое число, ml).
Так как радиус стационарной орбиты электрона прямо пропорционален квадрату главного квантового числа (ГКЧ) n
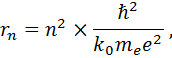
то скорость движения электрона по n -ой орбите должна быть обратно пропорциональна ГКЧ:
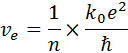
Тогда возможная энергия электрона в атоме на определённом энергетическом уровне вычисляется по формуле:
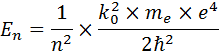

Минутка юмора:
А теперь серьёзно:
Основное состояние атома – такое состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, а все другие состояния атома называются возбуждёнными.
В основном состоянии электрон находится ближе всего к ядру и его энергия связи с ядром максимальна по модулю. При n → ∞ электрон удаляется от ядра на бесконечное расстояние, а его энергия связи с ядром стремится к нулю. В связи с этим, энергетические состояния с положительной энергией электрона называются свободными состояниями, а энергетические состояния с отрицательной энергией – связанными состояниями. Энергетический спектр свободных состояний непрерывен, а энергетический спектр связанных состояний дискретен.
Введём понятие энергии ионизации или потенциала ионизации. Энергия ионизации – это минимальное значение энергии, которую необходимо затратить для перевода электрона из основного состояния атома в свободное состояние.
Перейдём непосредственно к излучению и поглощению света, а для этого нам надо объяснить два основных понятия. Абсорбцией света называется поглощение последнего всем объёмом поглощающего вещества (сорбент). Испускание же электромагнитного излучения анализируемым веществом называется эмиссией.
Согласно Второму постулату Н. Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией (Ek) в стационарное состояние с меньшей энергией (En):
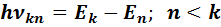
Поглощение же света происходит при переходе атома из стационарного состояния с меньшей энергией (En) в стационарное состояние с большей энергией (Ek).
Исходя из этого, атом, находясь в определённом стационарном состоянии, может излучать спектр возможных частот:

Такой спектр представляет собой ряд серий излучения, каждая из которых образуется при переходах атома в одно из фиксированных нижних энергетических состояний n из всех возможных верхних энергетических состояний k.
Все серии таких переходов названы в честь открывших их учёных:
1) серия Лаймана (1916) – переход в основное состояние (n = 1) с верхних энергетических уровней в диапазоне ультрафиолетового излучения;
2) серия Бальмера (1885) – переход в первое возбуждённое состояние (n=2) с верхних энергетических уровней в диапазоне видимого света;
3) серия Пашена (1908) – переход во второе возбуждённое состояние (n=3) с верхних энергетических уровней в диапазоне инфракрасного излучения;
4) серия Брэкета (1920) – переход в третье возбуждённое состояние (n=4) с верхних энергетических уровней в диапазоне инфракрасного излучения;
5) серия Пфунда (1924) – переход в четвёртое возбуждённое состояние (n=5) с верхних энергетических уровней в диапазоне инфракрасного излучения.

По величине потенциала ионизации химические элементы подразделяются на легко ионизируемые (Ei = 3,5…6 эВ), средне ионизируемые (Ei = 6…9 эВ) и трудно ионизируемые (Ei > 9 эВ).
Вот и подошло к концу наше путешествие по всем лабиринтам квантовой механики. Надеюсь, понравилось? Читайте и ждите выхода новых статей в группе «Физикохимия».