Неметаллы
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Кроме того, к неметаллам относят также водород и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Общие химические свойства неметаллов.
Окислительные свойства неметаллов. В реакциях с металлами неметаллы всегда являются окислителями. При взаимодействии металлов с кислородом образуются, как правило, оксиды. Например, при горении магния в кислороде образуется оксид магния:

При взаимодействии металлов с галогенами образуются галогениды металлов. Например, при взаимодействии железа с хлором образуется хлорид железа(III):
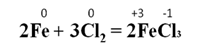
При взаимодействии некоторых активных металлов с водородом образуются гидриды металлов. Например, при нагревании натрия с водородом образуется гидрид натрия:
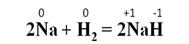
При нагревании активных металлов с азотом (только литий реагирует с азотом без нагревания) образуются нитриды, в которых азот проявляет степень окисления -3. Например, при нагревании калия с азотом образуется нитрид калия:
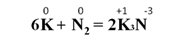
Другие бинарные соединения металлов также образуются при взаимодействии металлов с соответствующими неметаллами. При нагревании железного и серного порошков образуется сульфид железа(II):
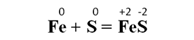
При взаимодействии магния с кремнием образуется силицид магния:
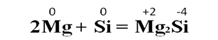
Неметаллы могут выступать в роли окислителей не только в реакциях с металлами, но и с другими неметаллами, значения относительной электроотрицательности которых будут ниже.
Например, при взаимодействии водорода с хлором водород проявляет восстановительные свойства, а хлор – окислительные:
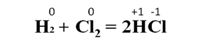
При горении серы в кислороде: сера – восстановитель, кислород – окислитель:
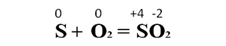
Кислород и некоторые другие неметаллы могут выступать в роли окислителей и в реакциях со сложными веществами. Горение метана в кислороде:
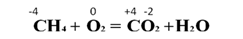
Реакции замещения более активными галогенами менее активных в солях:
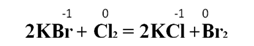
Восстановительные свойства неметаллов. осстановительные свойства неметаллов проявляются в реакциях как с другими (более электроотрицательными) неметаллами, так и с некоторыми сложными веществами.
В реакциях с фтором все неметаллы проявляют восстановительные свойства. А с кислородом только фтор будет выступать в роли окислителя. При взаимодействии азота с кислородом под действием электрического разряда образуется монооксид азота. Азот в данном случае выступает в роли восстановителя:
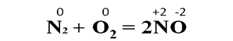
При взаимодействии фосфора с избытком хлора образуется пентахлорид фосфора:
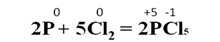
Сера проявляет восстановительные свойства, например, в реакции с концентрированной серной кислотой, в результате которой образуется сернистый газ и вода:
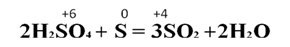
В составе серной кислоты сера – окислитель, а простое вещество сера – восстановитель.
Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Используется в качестве восстановителя при производстве многих металлов, например, молибдена и вольфрама, из их соединений.
Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов.
Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.
Алмаз используется при обработке твердых изделий, в буровых работах и ювелирном деле, графит – для изготовления электродов, тиглей для выплавки металлов, в производстве карандашей, резины и др.