Тема. НЕМЕТАЛЛЫ.
Неметаллы. Особенности строения атомов.
Неметаллы расположены в основном в правой верхней части ПСХЭ.
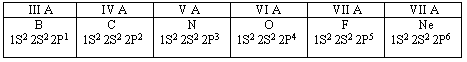
Давайте составим электронную конфигурацию атомов неметаллов группы 7, главной подгруппы. После составления конфигураций мы можем сделать вывод о том, что в группе количество электронов на внешнем уровне атомов неметаллов не изменяется.
Теперь давайте составим электронные конфигурации атомов неметаллов 2 периода.
Исходя их полученных схем, можем сделать вывод о том, что в периоде слева на право количество электронов на внешнем уровне увеличивается, а следовательно увеличивается и максимальная валентность элементов.
| Характеристики атома | Неметалл | Металл |
| Число валентных электронов | 4 и более | 1–3 |
| Радиус атома | Маленький | Большой |
| Электроотрицательность | Большая | Маленькая |
| Окислительно-восстановительные свойства | Окислитель и восстановитель | Восстановитель |
Особенности строения атомов неметаллов.
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
¾ меньший атомный радиус;
¾ четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары.Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
|
|
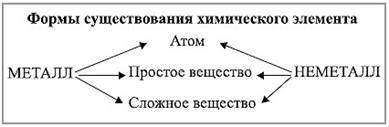
Неметаллы – простые вещества.
Простое вещество – это вещество состоящее из атомов одного и того же элемента. Простое вещество неметалл в газообразном состоянии существует в виде молекул. В твердом состоянии – существует в виде атомов.
Кристаллическое строение неметаллов - простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях: газы – H2, O2, O3, N2, F2, Cl2; жидкость – Br2; твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.