ПРИЛОЖЕНИЕ Е
Методические указания к выполнению лабораторных работ
По курсу «Мембраны и мембранные процессы»
Обратноосмотическое разделение водных растворов
Теоретические основы
Рабочее давление и температура — это основные факторы, с помощью
которых можно воздействовать на характеристики мембранного разделения
растворов с определенной концентрацией. Проведем качественный анализ
влияния этих факторов на основе уравнений переноса через мембрану воды и
растворенного вещества.
Для незаряженных обратноосмотических мембран с достаточно высокой селективностью эти уравнения можно записать в следующем виде:
Gв =А1/μп Св [P-(π3-π2)], (1.1)
Gp = A2(X3 – X2). (1.2)
где Gв и Gp — соответственно удельная производительность мембраны по воде и растворенному веществу, кг/(м2 с);
А1 и А2 — константы, зависящие от вида мембраны и в определенной степени от условий проведения процесса;
μп - вязкость пермеата, Па*с;
СВ - доля свободной воды в разделяемом растворе у поверхности мембраны;
Х3 и X2 - соответственно концентрация растворенного вещества у поверхности мембраны со стороны разделяемого раствора и в пермеате, мас. доли;
π3 и π2 — соответственно осмотическое давление разделяемого раствора у поверхности мембраны и пермеата, Па;
Р — рабочее давление (разность гидростатического давления над раствором и
пермеатом), Па.
Осмотическое давление растворов сильных электролитов полностью диссоциирующих на ионы, рассчитывается по формуле:
π = υ*φ*с*R*T (1.3)
где υ — число ионов, образующихся при диссоциации одной молекулы;
φ - практический осмотический коэффициент;
с - концентрация растворенного вещества (моль/л) раствора;
|
|
R - универсальная газовая постоянная (R=8,314 Дж/(моль*К));
Т — абсолютная температура, К.
Доля свободной воды Св, находится по соотношению:
Св = 1 – m3n / nв (1.4)
где n - число молекул воды, прочно связанных с ионами, на которые
диссоциирует молекула соли, моль воды/моль растворенного вещества;
nв - число молей воды в одном литре воды (nв =55.56 моль воды/литр воды);
шз — концентрация растворенного вещества у поверхности мембраны, моль
соли/моль воды;
m3 – концентрация растворенного вещества у поверхности мембраны, моль соли / моль воды.
Преобразуем уравнение переноса, сделав ряд упрощений. Во-первых,
пренебрежем концентрационной поляризацией создающей внешнее диффузионное сопротивление. Тогда:
Х3 = X1, π3 = π1,
где Х1 - концентрация, π1 - осмотическое давление разделяемого раствора в
объеме.
При этом уравнения (1.1) и (I.2) примут вид:
Gв =(А1/μп) Св [P-(π1-π2)], (1.5)
Gp = A2(X1 – X2). (1.6)
Во-вторых, будем считать, что используемая в установке мембрана
обладает высокой селективностью. Тогда GВ = G, где G — удельная
производительность по пермеату, х1 >> х2 и π1 >>π2, и уравнения (1.5) и (1.6)
упрощаются:
Gв =(А1/μп) Св [P-π1], (1.7)
Gp = A2 X1. (1.8)
С учетом (1.7) и (1.8) селективность можно представить в следующем виде:
φ = 1 – X2/X1 = 1 – (Gp/G)/X1 =
= 1 – [A2X1μn]/[A1Cв(P-π1)X1] =
= 1 – [A2μn]/[A1Cв(P-π1)] (1.9)
Проанализируем теперь влияние рабочего давления на удельную
производительность и селективность с помощью уравнений (!.7) и (l.9). Из
уравнения (1.7) видно, что с увеличением давления удельная произ-
водительность должна возрастать линейно, если не происходит уплотнения
мембраны, что будет проявляться в снижении константы A1. На практике
высокоселективные ацетатцеллюлозные мембраны не уплотняется до
давления порядка 5 МПа, а композитные — до 3 МПа.
|
|
Из уравнения (1.9) можно видеть, что селективность с увеличением давления также должна также возрастать, хотя и не линейно, если А1 и А2, остаются
постоянными.
Проанализируем влияние температуры разделяемого раствора. Как видно из уравнения (1.7), температура может сказываться на вязкости
пермеата, представляющего собой практически чистую воду, осмотическом
давлении разделяемого раствора и на величине константы А1, если в
исследуемом диапазоне температур изменяется набухаемость мембраны.
Поскольку осмотическое давление пропорционально абсолютной
температуре, а рабочее давление обычно в несколько раз больше осмотического, то при изменении температуры на 10-20 0С движущая сила (P-π1) изменяется всего на несколько процентов. На ацетатцеллюлозных мембранах в диапазоне температур от 0 до 40 0С константа А1 остается практически постоянной. Поэтому основной вклад в температурную зависимость удельной производительности вносит изменение вязкости
пермеата, то есть практически вязкости воды. Следовательно, с
достаточной точностью можно считать, что удельная производительность при
изменении температуры обратно пропорциональна вязкости пермеата. На
композитных мембранах возможно небольшое изменение величины A1 и
соотношение Gμn = const будет выполняться лишь приблизительно.
Селективность, как следует из уравнения (1.9), с увеличением
температуры должна возрастать, поскольку уменьшение вязкости с ростом
температуры более значительно, чем снижение движущей силы из-за роста
осмотического давления. Однако на практике при разделении растворов
неорганических солей на ацетатцеллюлозных мембранах селективность
возрастает незначительно или остается постоянной, а при высоких
концентрациях проходит через минимум. На композитных мембранах с
ростом температуры селективность обычно снижается. Причина такого
изменения селективности заключается в том, что с увеличением температуры
понижается упорядоченность в расположении молекул воды и снижается
толщина слоя связанной воды, благодаря которому и происходит задержание
растворенных веществ. Формально это выражается в росте константы А2.
|
|
Анализируя влияние давления и температуры, мы не учитывали влияние
концентрационной поляризации. Концентрационная поляризация, создающая
внешнее диффузионное сопротивление массопереносу в напорном канале,
обусловлена тем, что через мембрану переходит вода, а молекулы или ионы
растворенных веществ задерживаются у ее поверхности. Их концентрация
повышается до величины, при которой наступает равновесие: расход
растворенного вещества, отводимый от мембраны в объем раствора за счет
молекулярной или коллективной диффузии, становится равным расходу, который подводится вместе с поперечным потоком раствора, формирующим
пермеат. Явление повышения концентрации растворенного вещества у
поверхности мембраны называется концентрационной поляризацией, а
отношение концентрации у поверхности мембраны к концентрации в объеме
раствора называется величиной концентрационной поляризации и
обозначается КП.
Величина концентрационной поляризации с достаточно хорошим
приближением описывается уравнением:
КП = [ехp (G/β)] / [φи +(1-φи)ехp (G/β)]. (1.10)
где G — удельная производительность, м/с;
β - коэффициент массоотдачи
соли от поверхности мембраны в объем разделяемого раствора, м/с;
φи -
истинная селективность мембраны, определяемая соотношением
φи = (X3 – X2) / X3.
Связь между наблюдаемой селективностью (или просто «селективностью»),
определяемой соотношением φ = (X3 – Х2)/Х3 и истинной может быть
найдена по уравнению
In (1 - φ)/φ = G/β+ In (1- φи)/φи (1.11)
Коэффициент массоотдачи β рассчитывается из диффузионного критерия
Нуссельта Nu, который определяется на основе критериальных уравнений:
β = NuD/d; (1.12)
Nu = f(Re, Pr, Г1, Г2,...). (1.13)
где D — коэффициент молекулярной диффузии растворенного вещества в воде, м2/с;
dэ — эквивалентный диаметр напорного канала, м;
Рr = υ/D – диффузионный критерий Прандтля;
υ - кинематическая вязкость раствора, м2/с;
Г1, Г2 — симплексы геометрического подобия;
Re — критерий Рейнольдса.
В случае ламинарного потока разделяемого раствора в щелевых и
кольцевых каналах для расчета Nu можно использовать следующее
уравнение:
Nu = 1.67 Re3.34 Pr0.33(dэ/L)0.30 (1.14)
Значения Nu и соответствующие ему β в данном случае являются средними
по длине канала L, м.
Снизить величину концентрационной поляризации и таким образом
уменьшить ее влияние на характер зависимостей удельной производи-
тельности и селективности от давления и температуры можно путем
увеличения скорости потока в напорном канале.
Описание лабораторной установки и методики проведения экспериментов
Схема лабораторной установки высоко- и низконапорного обратного осмоса «BMT-RО» представлена на рис.1
Установка предназначена для выполнения лабораторных работ связанных с
обратноосмотическим разделением однородных жидких смесей. Студенты
изучают влияние давления и температуры на удельную производительность и
селективность.
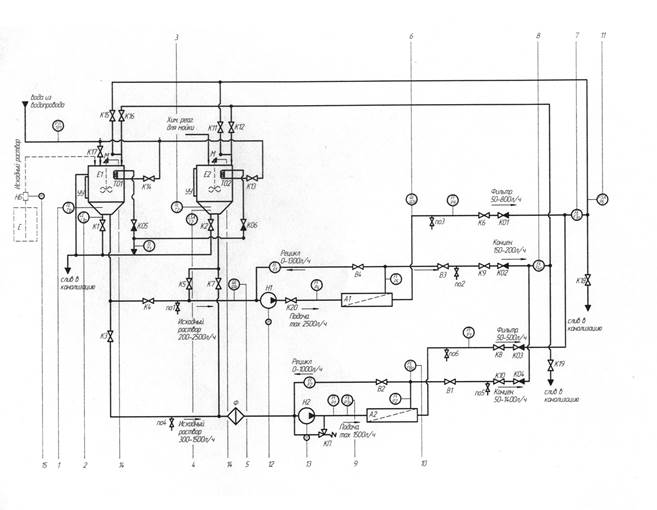
Рисунок 1 – Схема лабораторной установки высоко- и низконапорного обратного осмоса «BMT-RО»
Установка включает емкость Е, куда заливают от 3 до 5 л разделяемого раствора. Центробежный насос H1 засасывает раствор из емкости и создает
на выходе давление порядка 0,1 MПа, замеряемое манометром M1. Это
давление нужно для устойчивой работы лопастного ротационного насоса Н2,
на вход которого поступает раствор, выходя из насоса H1. Насос Н2 в свою
очередь, прокачивает раствор через напорный канал мембранного аппарата и обеспечивает необходимое для проведения обратного осмоса рабочее
давление, замеряемое манометром М2.
Сочетание необходимого давления и расхода устанавливается с помощью
регулирующего вентиля на линии концентрата и регулирующих вентилей
на байпасных линиях насосов. Концентрат и пермеат возвращаются
в емкость Е, предварительно проходя через ротаметры, с помощью
которых замеряется их расход (ротаметры откалиброваны в кг/ч). Отбор проб
концентрата и пермеата для проведения анализа осуществляется путем
открытия запорных вентилей.
Мембранный аппарат состоит из трубчатого корпуса, в котором
размещается рулонный модуль диаметром 0.064 м, состоящий из трех
совместно навитых элементов. Основной составной частью элемента является
трехслойная композитная мембрана с активным слоем из полиамида,
промежуточным полисульфоновым слоем и подложкой из полиэфира. Толщина сепарирующей сетки равна высоте напорного канала и составляет 0,7 мм. Длина напорного канала в модуле 0.24 м, его сечение 9.32*10-4 м2. Рабочая поверхность мембраны в модуле 0.64 м. (При замене модуля вышеприведенные характеристики могут измениться). В качестве растворенных веществ могут быть использованы NaC1, КС1, МgС12, СаС12, Na2SO4, K2SO4 и другие соли.
Для анализа их концентрации в растворе применяется прибор Сд - 97 фирмы
«Милваки», автоматически переводящий электропроводность в
концентрацию и учитывающий изменение температуры от 0 до 50'С.
Калибровочная кривая для конкретной соли выдается преподавателем.
Некоторые физико-химические свойства водных растворов и чистой воды,
используемые при выполнении расчетов., приведены в табл. 1 — 3.
Таблица 1 – Некоторые физико-химические свойства водных растворов при 25'С
| Соль | Концен- трация, мас.% | Осмоти- ческое давление. МПа | Плот- ность раствора. кг/м3 | Кинематическая вязкость*106, м2/с | Коэффициент диффузии*109, м2/с | |
| NaCl | 997.1 | 0.8963 | 1.610 | |||
| 0.581 | 0.46 | 1001.1 | 0.9009 | 1.483 | ||
| 1.156 | 0.92 | 1005.2 | 0.9054 | 1.475 | ||
| 1.723 | 1.37 | 1009,1 | 0.9100 | 1.475 | ||
| KCl | 997.1 | 0.8963 | 1.993 | |||
| 0.740 | 0.46 | 1001.8 | 0.8912 | 1.844 | ||
| 1.469 | 0.90 | 1006.4 | 0.8867 | 1.838 | ||
| 2.188 | 1011.0 | 0.8822 | 1.838 | |||
| MgС12 | 997.1 | 0.8963 | 1.249 | |||
| 0.943 | 0.64 | 1004.8 | 0.9197 | 1.074 | ||
| 1.869 | 1.30 | 1012.3 | 0.9475 | 1.051 | ||
| 2.778 | 2,00 | 1019.8 | 0.9766 | 1.041 | ||
| CaCl2 | 997.1 | 0.8963 | 1.335 | |||
| 1.098 | 0.63 | 1006.1 | 0.9167 | 1.285 | ||
| 2.172 | 1.28 | 1014.9 | 0.9373 | 1.281 | ||
| 3.222 | 1.95 | 1023.7 | 0.9562 | 1.292 | ||
| Na2SO4 | 997.1 | 0.8963 | 1.230 | |||
| 1.461 | 0.59 | 1009.7 | 0.9236 | 1.042 | ||
| 2.762 | 1.'12 | 1022.0 | 0.9511 | 1.008 | ||
| Na2 SO4 | 4.087 | 1.62 | 1034.0 | 0.9793 | 0.975 |
| К2 SO4 | 997.1 | 0.8963 | 1.954 | ||
| 1.713 | 0.58 | 1016.5 | 0.9067 | 1.301 | |
| 3.368 | 1.10 | 1022.5 | 0.9150 | 1.245 | |
| 4.968 | 1.61 | 1037.0 | 0.9214 | 1.198 |
Таблица 2 – Вязкость воды в зависимости от температуры
| Температура, 0С | Вязкость. Па*с*103 | Температура, 0С | Вязкость. Па*с*103 |
| 1,519 | 0.9358 | ||
| 1,473 | 0,9142 | ||
| 1.428 | 0,8937 | ||
| 1,386 | 0,8737 | ||
| 1,346 | 0,8545 | ||
| 1,308 | 0,8360 | ||
| 1,271 | 0,8180 | ||
| 1,236 | 0.8007 | ||
| 1,203 | 0,7840 | ||
| 1.171 | 0,7679 | ||
| 1.140 | 0,7523 | ||
| 1.111 | 0.7371 | ||
| 1,083 | 0,7225 | ||
| 1,056 | 0.7085 | ||
| 1,005 | 0,6814 | ||
| 0,9810 | 0,6685 | ||
| 0,9579 |
Таблица 3 – Координационные числа гидратации n некоторых ионов*
| Ион | N | Ион | N |
| Na+ | |||
| K+ | |||
| Cl- |
* При расчете Св по формуле (1.4) можно принять, что с ионом SO42- прочно связаны 32 молекулы воды
Лабораторная работа 1.
Исследование влияния рабочего давления на удельную производительность и селективность обратноосмотических мембран при работе на установке высоко- и низконапорного обратного осмоса «BMT-RО»;
Порядок выполнения работы
При полностью открытых регулирующих вентилях и закрытых запорных
нажатием кнопок на стенде последовательно включают насосы Н1 и Н2. При
этом происходит интенсивная циркуляция раствора в системе при нулевом
давлении по манометру М2.Работа в таких условиях продолжается 5 мин. За
это время происходит выравнивание концентрации в емкости Е и напорном
канале аппарата А. После этого открывают запорный вентиль на линии
концентрата В3 и отбирают необходимое для анализа количество раствора (20 — 30 мл). Полученная в результате анализа концентрация считается
концентрацией исходного раствора. После этого при заданных
преподавателем расходе концентрата и нескольких давлениях, определяемых
соответственно по ротаметру Р1 и манометру М2, проводят замеры расхода
пермеата (по ротаметру Р2) и отборы проб с помощью вентилей В31 и ВЗ2 на
анализ содержания растворенного вещества в концентрате и пермеате.
Рабочую температуру замеряют посредством погружения термометра в
емкость Е, поддерживают на уровне 25'С путем регулирования крана
подачи холодной воды в змеевик охлаждения 3 емкости Е. По окончании
экспериментов нажатием кнопок последовательно выключают насосы Н2 и H1
и перекрывают кран подачи водопроводной воды.
Обработка экспериментальных данных
Для всех испытанных давлений рассчитывают удельную
производительность G путем деления расхода пермеата на рабочую
поверхность мембраны, и селективность φ по формуле φ = (x1-x2 )/ x1,
где в качестве концентрации разделяемого раствора x1 берут
среднеарифметическую величину между концентрацией исходного раствора
и концентрата. Затем строят графики зависимостей G и φ от давления.
После этого с помощью уравнения (1.1) и экспериментально определенной удельной производительности рассчитывают А1 при минимальном и максимальном давлении, использованном в экспериментах.
При этом делают допущения, что GВ=G, а μп = μводы, которую находят из
табл 2.
Св — вычисляют по формуле (1.4). Осмотическое давление определяют с помощью таблицы 1, а для солей, не представленных в таблице, по формуле (1.3).
Величину концентрационной поляризации, необходимую для расчета m3
и π3 находят по уравнению (1.10), в котором Р определяют уравнением (1.12)
с использованием уравнения (1.14).
Расчеты выполняют на основе линейной скорости в напорном канале, которую рассчитывают из среднего расхода, представляющего собой сумму расхода концентрата и полурасхода пермеата.
Исходя из степени постоянства рассчитанных констант А1 и полученных графиков проводят теоретический анализ результатов по влиянию давления.
В отчете по работе приводят:
- упрощенную схему установки,
- краткое описание методики экспериментов,
- таблицы опытных данных и графики,
- выполненные расчеты константы А1,
- аналитические выводы по влиянию рабочего давления на
удельную производительность и селективность мембран.
Лабораторная работа 2.