ТЕМА:МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Основные положения молекулярно-кинетической теории ( МКТ):
1)вещество состоит из микрочастиц (атомов, молекул, ионов и т. д.);
2)микрочастицы пребывают в непрерывном хаотическом движении и взаимодействуют между собой.
На основании этого утверждения английский химик Джон Дальтон в 1803 г. объяснил закон постоянных отношений масс в химических реакциях.
Измерения микрочастиц вещества показали, что молекулы различных веществ сильно отличаются по размеру, в то же время все атомы имеют диаметр приблизительно 10-10 м.
Атомно-молекулярное учение утверждает, что газы состоят главным образом из атомов и молекул, большинство жидкостей имеет молекулярное строение, а структура кристаллических тел обусловлена взаимодействием ионов.
1827 г. опыт английского ботаника Роберта Броуна (1773 -1858).
Экспериментально изучая броуновское движение, французский физик Жан Перрен (1870 - 1942) выяснил, что оно происходит в результате теплового движения. Он установил, что интенсивность броуновского движения частиц возрастает с повышением температуры и не зависит химической природы частиц и времени их движения.
В 1905-1906 гг. Альберт Эйнштейн (1879 - 1955) и польский физик Мариан Смолуховский (1872-1917) сделали теоретическое обоснование броуновского движения с позиций молекулярно-кинетических представлений, чем окончательно подтвердили достоверность положений молекулярной физики.
Количество вещества
Небольшие размеры атомов и молекул обусловливают их незначительную массу ~ 10-27кг.
Поэтому в молекулярной физике массу молекул часто измеряют в атомных единицах массы (а.е.м.), сравнивая ее с 1/12 массы Углерода-12.
1 а.е.м = 1,6605655×10-27 кг
Размеры и масса молекул очень малы, а количество в макроскопическом теле – очень велико. (Например, в 1 г воды содержится около 3,3 × 1022 молекул).
Для упрощения расчетов, в физике и химии принято сравнивать количество атомов, молекул или иных структурных единиц в данном теле с количеством атомов в 12 г Углерода-12.
Отношение количества молекул N в данном теле к количеству атомов NA в 0,012 кг Углерода С-12 называется количеством вещества υ:
υ=N/NA
υ измеряется в моль или в кмоль.
Моль - это такое количество вещества, которое имеет столько же структурных элементов вещества, сколько содержится в 0,012 кг С-12. Эту величину называют постоянной Авогадро NA.
NA=6,022045×1023моль-1
Молярная масса- это масса 1 моля вещества (измеряется в кг/моль) и равна:
М= m0 × NA
Масса m произвольного количества вещества υ определяется из соотношения:
m = m0×N = υ×m0×NA = υ×M
Т.е. для расчета общего количества вещества:
N==NA×m/M
Основное уравнение молекулярно-кинетической теории
Газы легко сжимаются, поскольку собственный объем их молекул значительно меньше объема сосуда, который они заполняют.
Идеальный газ - это модель МКТ, отражающая свойства реальных газов, в которой размерами молекул и их взаимодействием можно пренебречь.
Давление газа возникает вследствие ударов о стенку сосуда большого количества молекул, которые передают ей свой импульс:
p=F/s
Уравнение состояния идеального газа:
Р = 1/3n×m0×V2,
где n - концентрация молекул газа, m0 - масса молекулы, V - ее средняя скорость.
Закон Бойля-Мариотта
Первый газовый закон был открыт в 1662 г английским ученым Робертом Бойлем (1627 - 1691):
между давлением и объемом данной массы газа при постоянной температуре существует обратная зависимость: 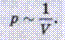
В 1676 г., французский ученый Эдм Мариотт (независимо от Р. Бойля) обобщенно сформулировал газовый закон: если при некоторой температуре данная масса газа занимает объем Vl под давлением p1, а в другом состоянии при той самой температуре его давление и объем равны V2 и р2, то выполняется соотношение: 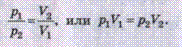
Закон Бойля-Мариотта: при постоянной температуре давление р данной массы газа обратно пропорционально занимаемому им объему V: p1/p2=V2/V1
Тепловой процесс, происходящий при постоянной температуре, называется изотермическим (от греч. isos - равный, thermi - теплота). Графически на координатной плоскости pV он изображается гиперболой, называемой изотермой.
Закон Гей-Люссака
В 1802 г. французский ученый Ж.Л.Гей-Люссак (1778-1850), исследуя зависимость объема газа от температуры при постоянном давлении, установил: относительное изменение объема данной массы газа при постоянно давлении прямо пропорционально изменению температуры:
V-V0/V0=α  t или V = V0(1+ αt).
t или V = V0(1+ αt).
Гей-Люссак определил, что все газы имеют одинаковый температурный коэффициент объемного расширения, равный α =1 /273К-1.
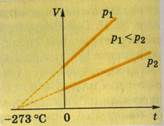 Тепловой процесс, в ходе которого давление остается постоянным, называется изобарным (от греч. isos- равный, baros - вес), а линии, изображающие его, - изобарами. На координатной плоскости зависимости объема V от температуры t изобары имеют вид прямых, сходящихся в одной точке. Их наклон зависит от значения давления. Изобара, соответствующая большему давлению, размещается ниже той, значение давления которой меньше.
Тепловой процесс, в ходе которого давление остается постоянным, называется изобарным (от греч. isos- равный, baros - вес), а линии, изображающие его, - изобарами. На координатной плоскости зависимости объема V от температуры t изобары имеют вид прямых, сходящихся в одной точке. Их наклон зависит от значения давления. Изобара, соответствующая большему давлению, размещается ниже той, значение давления которой меньше.
Абсолютная шкала температур
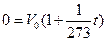 Если приравнять уравнение V = V0(1+ αt) закона Гей-Люссака к нулю как нижнему пределу объема, то получим значение наименьшей температуры по шкале Цельсия, которую могут иметь тела:
Если приравнять уравнение V = V0(1+ αt) закона Гей-Люссака к нулю как нижнему пределу объема, то получим значение наименьшей температуры по шкале Цельсия, которую могут иметь тела:
Отсюда:
T=-273 оС – нижний предел - абсолютный нуль.
Уильям Томсон (лорд Кельвин) (1824-1907) - английский физик, один из основателей термодинамики и молекулярно-кинетической теории, теории термоэлектрических явлений, основ электромагнитных колебаний, сформулировал второй закон термодинамики, ввел абсолютную шкалу температур (шкала Кельвина), произвел расчет размеров молекул. За выдающиеся научные достижения удостоен титула лорда Кельвина.
Абсолютная шкала температур
1 К = 273 оС; T=t+273
1+ α t= α +1/273(T-273)= α T, то
V=Vo α T
V1/V2=T1/T2,
Очевидно, что на координатных плоскостях рТ и pV изобарами являются прямые, перпендикулярные к оси давления.
Закон Шарля
Выяснить функциональную зависимость между параметрами газа в физике означает найти уравнение его состояния. Установлено, что для этого достаточно трех величин - давления р, объема V и температуры Т.
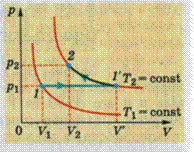
Проведем опыты показанные на рисунке: сначала изобарное расширение, затем изотермическое сжатие.
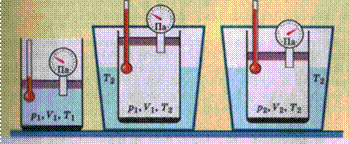
Графическое изображение изменение состояния газа показано на рисунке.
 | |||
 |


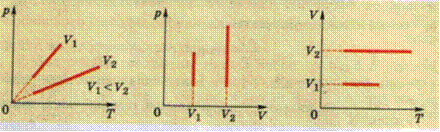
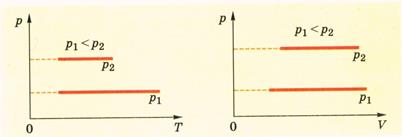
Зависимость давления от температуры при изохорном процессе можно записать также в виде прямой пропорциональности между давлением и абсолютной температурой:
Р=р0γТ
где р0 - давление газа при температуре Т0 = 273 К,
γ- температурный коэффициент давления, равный 1/273 К-1
Учитывая соотношение между абсолютной температурой Т и температурой по шкале Цельсия t (Т= t + 273), получаем газовый закон, впервые открытый французским физиком Ж.Шарлем (1746-1823):
р = р0(1+γ t).
Согласно закону Шарля изохорные процессы происходят таким образом, что между давлением и температурой идеального газа существует линейная зависимость - с повышением температуры данной массы газа его давление возрастает.
p1/р2=Т1/Т2 при V=const.