ПОНЯТИЯ:
1. **Классификация веществ – это объединение в группы (классы) веществ с принципиально одинаковым строением и сходными (близкими) свойствами. Она позволяет систематизировать знания о веществах и облегчить их изучение.
2. **Класс веществ – это группа веществ с принципиально одинаковым строением и сходными (близкими) свойствами. Выделяют четыре основных класса неорганических соединений: оксиды, кислоты, основания и соли.
3. **Номенклатура (от лат. nomenclatura – список)– это химическая система названий химических элементов и их соединений, которая обеспечивает чёткое обозначение состава вещества, как при написании, так и в разговорной речи. Бывает: историческая (тривиальная), рациональная и международная (систематическая). Основные положения международной номенклатуры разрабатывает и рекомендует к использованию международный союз чистой (теоретической) и прикладной химии (в английской аббревиатуре IUPAC).
4. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых всегда кислород, а вторым элементом может быть как металл, так и неметалл. Делятся на несолеобразующие и солеобразующие.
** К оксидам не относится соединение OF2 (фторид кислорода) и пероксиды (соединения, которые содержат группировку атомов –О–О–).
5. **Несолеобразующие оксиды – это оксиды неметаллов, которые не образуют соли при взаимодействии с кислотами или щелочами. Их мало: N2O, NO, CO, SiO и некоторые другие.
6. *Солеобразующие оксиды – это оксиды металлов и большинство неметаллов, которые образуют соли при взаимодействии с кислотами или щелочами. Они делятся на основные, амфотерные и кислотные.
7. Основные оксиды – это оксиды металлов с валентностью I или II, которые образуют соли при взаимодействии с кислотами и кислотными оксидами. Им соответствуют основания (щелочи или нерастворимые неамфотерные).
Например: NaI2O → NaIOH CaIIO → CaII(OH)2
FeIIO → FeII(OH)2↓ CrIIO → CrII(OH)2↓
8. *Амфотерность (от греч. amphi – с обоих сторон) – это свойство химических элементов и их соединений проявлять двойственные свойства, т.е. в зависимости от условий, свойства кислот и щелочей.
9. *Амфотерные оксиды – это оксиды металлов с валентностью III или IV (иногда II и V), которые образуют соли при взаимодействии с кислотами, щелочами, кислотными и основными оксидами. Им соответствуют нерастворимые амфотерные основания.
Например: AlIII2O3 → AlIII(OH)3↓ CrIII2O3 → CrIII(OH)3↓
PbIVO2 → PbIV(OH)4↓ SnIVO2 → SnIV(OH)4↓
10. Кислотные оксиды – это оксиды неметаллов (кроме несолеобразующих и воды), а также металлов с валентностью VI, VII и VIII (иногда V), которые образуют соли при взаимодействии со щелочами, основными или амфотерными оксидами. Им соответствуют кислоты.
Например: SO3 → H2SO4 СO2 → [H2CO3]
P2O5 → H3PO4 СrVIO3 → [H2CrVIO4]
MnVII2O7 → HMnVIIO4
11. Реакция разложения – это химическая реакция, в результате которой из одного вещества, образуются несколько новых веществ. В результате реакции могут образовываться как простые, так и сложные вещества.
Общая схема реакции: АВС ® А + ВС.
12. Реакция соединения – это химическая реакция, в результате которой из нескольких веществ, образуется одно новое вещество. В реакцию могут вступать как простые, так и сложные вещества.
Общая схема реакции: А + ВС ® АВС.
13. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков. Атомы водорода способны замещаться на атомы металлов. Число атомов водорода показывает валентность кислотного остатка, а также основность кислоты.
*Основность кислоты – это количество атомов водорода в кислоте, способных замещаться на атомы металлов. Показывает сколько рядов солей может образовать данная кислота (Н1 – одноосновная – один ряд солей; Н2 – двухосновная – два ряда солей; Н3 – трехосновная – три ряда солей и т.д.).
14. Бескислородные кислоты – это кислоты, в кислотных остатках которых отсутствуют атомы кислорода.
15. Кислородсодержащие кислоты – это кислоты, в кислотных остатках которых присутствуют атомы кислорода.
16. Индикатор (от лат. indikator – указатель) – это сложное вещество (как правило, органическое), которое изменяет свой цвет под действием кислот и (или) щелочей, в результате изменения своей структуры. Главными индикаторами на кислоту являются лакмус и метилоранж, а на щелочь – фенолфталеин.
| Индикатор | Окраска в | ||
| воде | кислоте | щёлочи | |
| Лакмус | фиолетовый | красный | синий |
| Метилоранж | оранжевый | розовый | жёлтый |
| Фенолфталеин | бесцветный | бесцветный | ярко-малиновый |
17. **Сильный индикатор – это индикатор, который изменяет свой цвет в кислой среде. Например: лакмус и метилоранж.
18. **Слабый индикатор – это индикатор, который изменяет свой цвет в щёлочной среде. Например: фенолфталеин.
19. **Двухцветный индикатор – это индикатор, имеющий неодинаковый цвет в кислой и щелочной средах. Например: лакмус и метилоранж.
20. **Одноцветный индикатор – это индикатор, изменяющий цвет только в щелочной среде. Например: фенолфталеин.
21. *Ряд активности металлов – это ряд металлов, расположенных в порядке уменьшения их металлической активности. Металлы, стоящее в данном ряду правее водорода, не вытесняют его из растворов кислот. Впервые составил данный ряд Н.Н. Бекетов (Россия, 1863 год).
| Активные металлы | Металлы средней активности | Н | Малоактивные металлы | Неактивные металлы |
| Li K Ca Na | Mg Al Mn Zn Fe Ni Sn Pb | Cu Hg Ag | Pt Au |
22. Реакция замещения – это химическая реакция между простым и сложным веществами, в результате которой атомы, образующие простое вещество замещают один или несколько атомов сложного вещества.
Общая схема реакции: А + ВС ® АС + В.
23. Реакция обмена – это химическая реакция между двумя сложными веществами, в результате которой они обмениваются своими составными частями.
Общая схема реакции: АД + ВС ® АС + ВД.
24. Основания – это сложные вещества, состоящие из атомов металлов и гидроксильных групп (групп ОН-1). Число гидроксильных групп равно валентности металла. Они делятся на растворимые и нерастворимые.
25. Щёлочи – это растворимые в воде основания.
26. *Амфотерные гидроксиды (основания) – это основания, которые в зависимости от условий проявляют свойства, как кислот, так и щелочей. Они нерастворимы в воде.
27. Реакция нейтрализации – это химическая реакция между кислотой и основанием, в результате которой образуется соль и вода. Относится к реакциям обмена.
Общая схема реакции: НКО + MetOH → MetКО + Н2О.
28. Средние соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. Они образуются при полном замещении атомов водорода в кислотах на атомы металла.
Названия этих солей имеют суффиксы:
–ид (если кислотный остаток бескислородный). Например: MetS II – сульф ид;
–ит (если неметалл в кислородсодержащем кислотном остатке имеет низшую валентность). Например: MetS IV O3 – сульф ит;
–ат (если неметалл в кислородсодержащем кислотном остатке имеет высшую валентность). Например: MetS VI O4 – сульф ат.
29. *Кислые соли – это сложные вещества, состоящие из атомов металла, водорода и кислотных остатков. Они образуются при неполном замещении атомов водорода в кислотах на атомы металла.
В названиях этих солей всегда присутствует приставка гидро- (дигидро-).
30. **Основные соли – это сложные вещества, состоящие из атомов металла, гидроксильных групп и кислотных остатков. Они образуются при неполном замещении гидроксогрупп в основании на кислотные остатки.
В названиях этих солей всегда присутствует приставка гидроксо- (дигидроксо-).
31. **Двойные соли – это сложные вещества, состоящие из атомов двух разных металлов (или металла и катионов аммония NH4+1) и кислотных остатков. Существуют только в кристаллическом виде.
32. **Смешанные соли – это сложные вещества, состоящие из атомов металла и двух разных кислотных остатков. Существуют только в кристаллическом виде.
33. Генетическая связь (от греч. genesis – происхождение) – это цепь химических превращений, которая показывает взаимосвязь между различными классами неорганических соединений.
Выделяют две главных цепи превращений:
1) Met 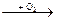 MetO
MetO 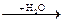 MetOH
MetOH 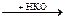 MetKO
MetKO
Например: Ca 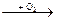 CaO
CaO 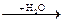 Ca(OH)2
Ca(OH)2 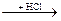 CaCl2
CaCl2
1) 2Ca + O2 → 2CaO
2) CaO + H2O → Ca(OH)2
3) Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2) неMet 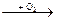 неMetO
неMetO 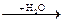 HКО
HКО 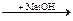 MetKO
MetKO
Например: S 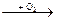 SO2
SO2 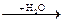 H2SО3
H2SО3 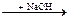 Na2SО3
Na2SО3
1) S + O2  SO2↑
SO2↑
2) SO2 + H2O → H2SO3
3) H2SO3 + 2NaOH → Na2SO3 + 2H2O
| ТАБЛИЦА ВЗАИМОДЕЙСТВИЯ КНС ДРУГ С ДРУГОМ | Средняя соль | Средняя соль + металл | Нет | Нет | Нет | Нет | Новая соль + новая кислота | Новая соль + новое основание | Две новых соли |
| Щёлочь | Амфотерный металл: соль + водород | Различные соли + вода | Нет | При t˚: средняя соль + вода | Средняя соль + вода (или кислая соль) | Средняя (кислая) соль + вода | Комплексные соединения | Новая соль + новое основание | |
| Кислота | Средняя соль + водород | С конц. кисло-тами: различные продукты | Средняя соль + вода | Средняя соль + вода | Нет | Нет | Средняя соль + вода | Новая соль + новая кислота | |
| Вода | Щёлочь (или оксид) + водород | Различные продукты | Щёлочь | Нет | Кислота | Нет | Нет | **Процесс гидролиза | |
| Кислотный оксид | Нет | Если уголь: неMet + CO2 | Средняя соль | Средняя соль | Нет | Нет | Нет | Нет | |
| Основный оксид | Нет | Если Н2: Met + вода | Нет | Средняя соль | Средняя соль | Средняя соль + вода | Нет | Нет | |
| Неметалл | Средняя соль | Если Н2 –кислота, а О2 – оксид | Если уголь (C): Met + CO | Если уголь: Met + CO | Если уголь: неMet + CO2 | С конц. кисло-тами: различные продукты | Нет | Нет | |
| Металл | Нет | Средняя соль | Нет | Нет | Нет | Средняя соль + водород | Нет | Средняя соль + металл | |
| Классы | Металл | Неметалл | Основный оксид | Амфотерный оксид | Кислотный оксид | Кислота | Нерастворимое основание | Средняя соль |
| ХИМИЧЕСКИЕ ФОРМУЛЫСОЕДИНЕНИЙ | СРЕДНИЕ СОЛИ | MetClI – хлорид | MetBrI – бромид | MetII – йодид | MetFI – фторид | MetNO3I – нитрат | MetSII – сульфид | MetSO3II – сульфит | MetSO4II – сульфат | MetSiO3II – силикат | MetCO3II – карбонат | MetPO4III – фосфат (ортофосфат) | *MetNO2I – нитрит | ||||||||||
| ОСНОВАНИЯ | ЩЕЛОЧИ: | NaOH гидроксид натрия | KOH гидроксид калия | Ca(OH)2 гидроксид кальция | Ba(OH)2 гидроксид бария | НЕРАСТВОРИМЫЕ НЕАМФОТЕРНЫЕ | Mg(OH)2 гидроксид магния | Fe(OH)2 гидроксид железа (II) | Cu(OH)2 гидроксид меди (II) | ||||||||||||||
| КИСЛОТЫ | HCI соляная (хло-роводородная) | HBr бромоводо-родная | HI йодоводородная | HF фтороводород-ная (плавиковая) | HNO3 азотная | H2S сероводородная | H2SO3 сернистая | H2SO4 серная | [H2CO3] угольная | H2SiO3 кремниевая | H3PO4 фосфорная (ортофосфорная) | ||||||||||||
| СОЛЕОБРАЗУЮЩИЕ ОКСИДЫ | Кислотные | SO2 оксид серы (IV) | SO3 оксид серы (VI) | CO2 оксид углерода (IV) | NO2 оксид азота (IV) | SiO2 оксид кремния(IV) | P2O5 оксид фосфора(V) | N2O5 оксид азота (+5) | *CrO3 оксид хрома (VI) | ||||||||||||||
| Амфотерные | ZnO оксид цинка | *PbO оксид свинца (II) | Al2O3 оксид алюминия | Cr2O3 оксид хрома (IIІ) | Fe2O3 оксид железа (III) | *SnO2 оксид олова (IV) | *PbO2 оксид свинца (IV) | MnO2 оксид марганца (IV) | |||||||||||||||
| Основные | Na2O оксид натрия | K2O оксид калия | CaO оксид кальция | MgO оксид магния | BaO оксид бария | CuO оксид меди (II) | FeO оксид железа (II) | Ag2O оксид серебра | |||||||||||||||
| *КИСЛЫЕ СОЛИ | К названию средней соли добавляется приставка гидро- или дигидро- | *МetHSI – гидросуль-фид | *МetHSO3I – гидро-сульфит | *МetHSO4I – гидро-сульфат | *MetHCO3I – гидро-карбонат | *MetH2PO4I – ди-гидрофосфат | *MetHPO4II – гидро-фосфат | ||
| ОСНОВАНИЯ | нерастворимые АМФОТЕРНЫЕ | Zn(OH)2 гидроксид цинка | *Pb(OH)2 гидроксид свинца (II) | *Sn(OH)2 гидроксид олова (II) | Al(OH)3 гидроксид алюминия | Cr(OH)3 гидроксид хрома (III) | Fe(OH)3 гидроксид железа (III) | *Pb(OH)4 гидроксид свинца (IV) | *Sn(OH)4 гидроксид олова (IV) |
| КИСЛОТЫ | **HCN циановодородная (синильная) | *HNO2 азотистая | *HPO3 метафосфорная | *HClO хлорноватистая | *HClO2 хлористая | *HClO3 хлорноватая | *HClO4 хлорная | *H3ВO3 борная | |
| *НЕСОЛЕОБРАЗУЮЩИЕ ОКСИДЫ | *СO оксид углерода (II) | *NO оксид азота (II) | *N2O оксид азота (I) | *SiO оксид кремния (II) |