| Классификация: | |
| По числу атомов Н: Н1 – одноосновные – HCl Н2 – двухосновные – H2SO4 Н3 – трёхосновные – H3РO4 | По присутствию атомов О: Бескислородные – HCl; H2S Кислородсодержащие – H2SO4 |
Получение:
1) Прямой синтез (соединение водорода с неметаллом, с последующим растворением в воде, полученного продукта):
H2 + Cl2 → 2HCl↑
2) Взаимодействие кислотного оксида с водой:
SO3 + H2O → H2SO4
*3) Взаимодействие кристаллической соли с более сильной или менее летучей кислотой:
2NaСl + H2SO4(к)  2HCl↑ + Na2SO4
*4) Взаимодействие раствора соли и раствора кислоты (если один из продуктов выпадает в осадок или образуется в виде газа):
BaCl2 + H2SO4 → 2HCl + BaSO4↓ 2HCl↑ + Na2SO4
*4) Взаимодействие раствора соли и раствора кислоты (если один из продуктов выпадает в осадок или образуется в виде газа):
BaCl2 + H2SO4 → 2HCl + BaSO4↓
| |
| Физические свойства: Большинство кислот бесцветные жидкости, кислые на вкус, ядовиты, хорошо растворимые в воде (кроме, кремниевой кислоты). Некоторые неорганические кислоты – твердые вещества белого цвета: 100 % фосфорная, кремниевая, борная и другие. При попадании на кожу кислоты вызывают сильные ожоги, особенно концентрированные серная и азотная кислоты. | |
Химические свойства:
1) HKO + Met (в ряду активности металлов до Н) → MetKO + H2↑
2HCl + Zn → ZnCl2 + H2↑
2) HKO + MetO → MetKO + H2O2HCl + ZnO → ZnCl2 + H2O
3) НKO + MetOH → MetKO + H2O2HCl + Zn(OH)2 → ZnCl2 + 2H2O
*4) HKO + NH3 → NH4KOHCl + NH3 → NH4Cl
*5) HKO + соль → новая соль + новая кислота
HCl + AgNO3 → AgCl↓ + HNO3
6) HKO → неMet + H2↑илиHKO → неMetO + H2O
2HCl 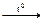 Cl2↑ + H2↑ H2SO4 Cl2↑ + H2↑ H2SO4  SO3 + H2O SO3 + H2O
|
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОСНОВАНИЯХ
Получение:
Щёлочи получают:
*1) Электролиз растворов бескислородных солей щелочных и щелочноземельных металлов:
2NaCl + 2H2O 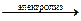 Cl2↑ + H2↑ + 2NaOH
2) Взаимодействие оксидов щелочных и щелочноземельных металлов с водой: СaO + H2O → Ca(OH)2
*3)Взаимодействие раствора соли с раствором щелочи (если один из продуктов выпадает в осадок): K2CO3 + Ca(OH)2 → CaCO3↓+ 2KOH
4)Взаимодействие щелочных и щелочноземельных металлов с водой (имеет только теоретическое значение): 2Na + 2H2O → 2NaOH + H2↑
Нерастворимые основания получают:
Взаимодействие щелочей с растворами солей (если новое основание выпадает в осадок): CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl Cl2↑ + H2↑ + 2NaOH
2) Взаимодействие оксидов щелочных и щелочноземельных металлов с водой: СaO + H2O → Ca(OH)2
*3)Взаимодействие раствора соли с раствором щелочи (если один из продуктов выпадает в осадок): K2CO3 + Ca(OH)2 → CaCO3↓+ 2KOH
4)Взаимодействие щелочных и щелочноземельных металлов с водой (имеет только теоретическое значение): 2Na + 2H2O → 2NaOH + H2↑
Нерастворимые основания получают:
Взаимодействие щелочей с растворами солей (если новое основание выпадает в осадок): CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl
|
| Физические свойства: Щелочи – белые кристаллические вещества мыльные на ощупь, с водой смешиваются в любых отношениях. При попадании на кожу щелочи вызывают сильные ожоги, особенно при попадании на кожу концентрированных щелочей. Нерастворимые основания – аморфные (студенистые) осадки, многие их них со временем теряют воду, превращаясь в соответствующие оксиды. Некоторые нерастворимые основания окрашены: Cu(OH)2 – голубой осадок; Fe(OH)3 – бурый осадок; Mg(OH)2, Zn(OH)2, Al(OH)3 – белые осадки. |
Химические свойства:
1) MetOH (любое основание) + HKO → MetKO + H2O
NaOH + HCl → NaCl + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
2) MetOH (щёлочь) + кислотный оксид → MetKO + H2O
2NaOH + SO3 → Na2SO4 + H2O
3) MetOH (щёлочь) + соль → новая соль + новое основание (↓)
2NaOH + ZnCl2 → Zn(OH)2↓+ 2NaCl
4) MetOH (↓)  MetO + H2O
Mg(OH)2 MetO + H2O
Mg(OH)2  MgO + H2O MgO + H2O
|
ОСНОВНЫЕ СВЕДЕНИЯ
О СРЕДНИХ СОЛЯХ
| Получение: 1) Met + неMet → MetKOZn + Cl2 → ZnCl2 2) Met + HKO → MetKO + H2 Zn + 2HCl → ZnCl2 + H2↑ 3) MetO + неMetO → MetKOZnO + SO3 → ZnSO4 4) MetO + HKO → MetKO + H2OZnO + 2HCl → ZnCl2 + H2O 5) MetOH + HKO → MetKO + H2O Zn(OH)2 + 2HCl → ZnCl2 + 2H2O 6) Щёлочь + неMetО → MetKO + H2O Ca(OH)2 + CO2 → CaCO3↓ + H2O |
| Физические свойства: Все соли – твердые кристаллические вещества, имеющие высокую температуру плавления. Окрашены в различные цвета: Соли натрия, калия, магния, кальция, цинка, бария, алюминия – в большинстве белые; соли меди – зеленые или синие; соли железа – светло-зеленые, желтые или бурые; *соли хрома – зеленые, синие, желтые или оранжевые; *соли никеля – светло-зеленые; *соли кобальта – розовые. По растворимости в воде соли делятся на три группы: · растворимые – в таблице растворимости обозначаются буквой Р; · малорастворимые – обозначаются буквой М; · нерастворимые – обозначаются буквой Н. |
Химические свойства:
MetKO + HA (кислота) → MetA + HKO
CuSO4 + H2S → CuS↓ + H2SO4
MetKO + ВОН (щёлочь) → MetОН + ВKO
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MetKO + ВА (соль) → MetА + ВKO (две новых соли, одна↓)
CuSO4 + Na2S → CuS↓ + Na2SO4
MetKO + В (металл – более активный, чем Met) → Met + ВKO
CuSO4 + Fe → FeSO4 + Cu
MetKO  MetО + неMetOилиMetKO MetО + неMetOилиMetKO  Met + неMet
CuSO4 Met + неMet
CuSO4  CuO + SO3
CuCl2 CuO + SO3
CuCl2  Cu + Cl2↑ Cu + Cl2↑
|
| Качественные реакции на КИСЛОТЫ, ОСНОВАНИЯ И СОЛИ | Уравнение реакции | NaCl+AgNO3 → AgCl↓+ NaNO3 | NaBr+AgNO3 → AgBr↓+ NaNO3 | NaI+AgNO3 → AgI↓+ NaNO3 | 2NaI+Pb(NO3)2 → PbI2↓+ 2NaNO3 | Na2S+2AgNO3 → Ag2S↓+ 2NaNO3 | Na2S +Pb(NO3)2 → PbS↓+ 2NaNO3 | Na2SO4+BaCl2 → BaSO4↓+ 2NaCl | Na2CO3+2HCl →2NaCl +CO2↑+ H2O | Na2CO3 +СaCl2 → CaCO3↓+ 2NaCl | Na2SiO3+2HCl →2NaCl + H2SiO3↓ | Na3PO4+3AgNO3→Ag3PO4↓+3NaNO3 | ||
| Эффект реакции | Раствор красного цвета | Раствор розового цвета | Раствор ярко-малинового цвета | Белый творожистый осадок | Бледно-жёлтый осадок | Жёлтый осадок | Ярко-жёлтый осадок | Чёрный осадок | Тёмно-коричневый осадок | Белый осадок | Бесцветный газ | Белый осадок | Белый аморфный осадок | Жёлтый осадок |
| Реагент | Лакмус | Метилоранж | Фенолфталеин | Нитрат серебра | Нитрат серебра | Нитрат серебра | Нитрат свинца (II) | Нитрат серебра | Нитрат свинца (II) | Хлорид бария | Сильная кислота | Хлорид кальция | Сильная кислота | Нитрат серебра |
| Вещество | Кислота | Щёлочь | Хлорид | Бромид | Йодид | Сульфид | Сульфат | Карбонат | Силикат | Фосфат |
** ТРИВИАЛЬНЫЕ НАЗВАНИЯ
НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
| Простые вещества | Оксиды | Кислоты | |
| О3 – озон S8 – молекулярная или ромбическая сера Р4 – белый фосфор С∞ – алмаз, графит | СО – угарный газ СО2 – углекислый газ N2О – веселящий газ NО2 – бурый газ SО2 – сернистый газ Al2О3 – корунд Al2О3 (красный) – рубин Al2О3 (синий) – сапфир SiО2 – кварц, песок СаО – негашёная известь MgО – жженая магнезия MnО2 – пиролюзит Fe2О3 – гематит Fe3О4 – магнетит PbО – свинцовый глёт Pb3О4 – сурик | Н2SO4 – купоросное масло, «хлеб химии» Н2S2O7 – олеум HNO3(конц.) + 3HCl(конц) – «царская водка» | |
| Средние соли | |||
| NaCl – каменная или поваренная соль, галит КCl – сильвин NH4Cl – нашатырь CaCO3 – мел, мрамор, известняк MgCO3 – магнезит Na2CO3 – бельевая или кальцинированная сода К2CO3 – поташ NaNO3 – чилийская селитра KNO3 – индийская селитра Са3(РО4)2 – фосфорит KMnO4 – «марганцовка» KClO3 – бертолетова соль FeS2 – пирит, железный (серный) колчедан ZnS – сфалерит PbS – галенит HgS – киноварь | Основания | ||
| NaOH – едкий натр KOH – едкое кали Ca(OH)2 – гашёная известь, известковое молоко Ba(OH)2 – баритовая вода [NH4OH] – нашатырный спирт, аммиачная вода | |||
| Основные соли | |||
| Кислые соли | Cu2(OH)2CO3 – малахит | ||
| NaHCO3 – питьевая сода СaHРO4 – преципитат Сa(H2РO4)2 – двойной суперфосфат | |||
| Двойные соли | |||
| КAl(SO4)2 – алюмокалиевые квасцы (NH4)2Fe(SO4)2 – соль Мора | |||
| Кристаллогидраты | |||
| CuSO4·5Н2О – медный купорос ZnSO4·7Н2О – цинковый купорос FeSO4·7Н2О – железный купорос MgSO4·7Н2О – эпсомская соль, эпсомит CaSO4·2Н2О – природный гипс Na2SO4·10Н2О – глауберова соль, мирабилит Na2CO3·10Н2О – техническая сода |