Тема 25. СЛОЖНЫЕ ЭФИРЫ.
Сложные эфиры – производные кислородсодержащих кислот (карбоновых и минеральных), в которых атом водорода гидроксильной группы замещен на углеводородный радикал.

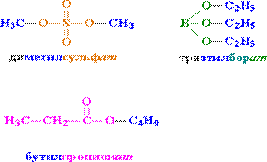
Общая формула сложных эфиров, образованных остатками предельных карбоновой кислоты и спирта. СnH2nO2 или R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты H–COO–R1.
Номенклатура сложных эфиров
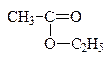
| ||
| этилацетат | ||
| углеводородный заместитель | + | кислотный остаток |
Названия по ИЮПАК выделены жирным шрифтом:
| H–COO–C2H5 | CH3–COO–CH3–CH3 | CH2CH2–COO–C2H5 |
| Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты | Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты | Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |
По систематической номенклатуре названия сложных эфиров образуются путем прибавления к названию аниона кислоты приставки с названием УВ радикала спирта. Название аниона кислоты оканчивается на –ат или –оат.
НАЗВАНИЕ СЛОЖНОГО ЭФИРА

название УВ радикала спирта + название аниона кислоты (-ат)
С3Н7 – СООСН3
метилбутират или метилбутаноат или метиловый эфир бутановой кислоты
ИЗОМЕРИЯ СЛОЖНЫХ ЭФИРОВ
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат.
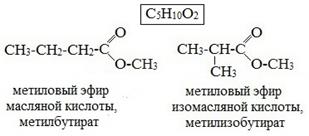 и
и 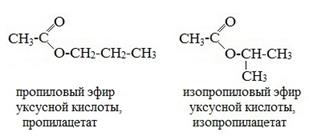
1. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират
. 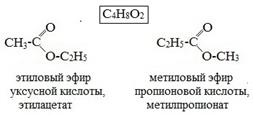 или
или 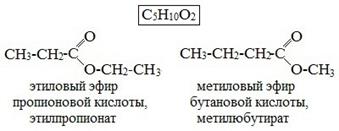
2. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.
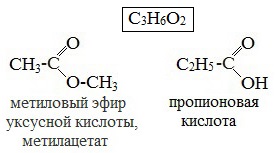 или
или 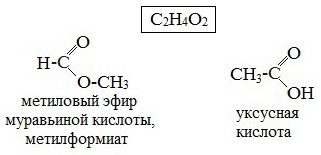
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс -изомерия.
ФИЗИЧЕСКИЕ СВОЙСТВА
Сложные эфиры являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3
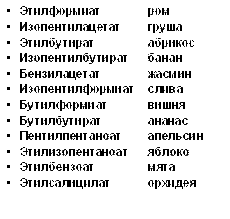
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами. Табл. 1.
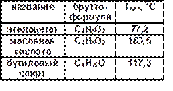
СПОСОБЫПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ.
1. Взаимодействие кислот со спиртами:

Это наиболее распространенный способ получения сложных эфиров.
2. Синтез сложных эфиров методом конденсации альдегидов:
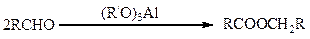
Синтез сложных эфиров из альдегидов (реакция Тищенко) осуществляется в присутствии алкоголята алюминия, активированного хлоридом железа или, что лучше, хлоридом алюминия и окисью цинка. Данный метод имеет промышленное значение.
3. Присоединение органических кислот к алкенам:

4. Синтез сложных эфиров путем дегидрогенизации спиртов:
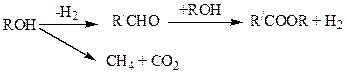
5. Получение сложных эфиров методом переэтерификации.
Данная реакция имеет две разновидности: реакция обмена между эфиром и спиртом спиртовыми радикалами (реакция алкоголиза):
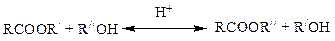
и реакция обмена кислотными радикалами у спиртовой группы эфира:
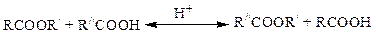
6. Синтез эфиров из ангидридов кислот и спиртов:
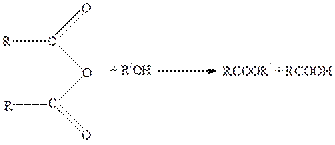
7. Взаимодействие кетонов со спиртами:
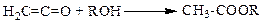
8. Взаимодействие между галоидангидридами и спиртами:

9. Реакция между серебряными или калиевыми солями кислот и алифатическими галоидными производными:

10. Взаимодействие кислот с алифатическими диазосоединениями (в основном с диазометаном):

Основными продуктами реакции этерификации являются сложные эфиры, используемые в качестве растворителей, пластификаторов, синтетических смазочных масел и гидравлических жидкостей, душистых веществ, мономеров.
Этерификацию спиртов карбоновыми кислотами можно проводить в отсутствии катализатора, но в этом случае она протекает медленно и для достижения достаточной скорости требуется высокая температура (200-300ОС). Но когда примесь катализатора трудно отмывается, применяют именно некаталитический процесс. В присутствии кислотных катализаторов этерификация протекает при температуре 70-150ОС.
Наиболее распространенными катализаторами этерификации являются минеральные кислоты: серная, фосфорная.
Получение:
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
R–COOН + НО - R' «R–COOR' + Н2О
В присутствии сильных неорганических кислот гидроксильная группа обратимо обменивается на остаток спирта:
Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложного эфира.
Вывод: в кислой среде химическое равновесие смещается в сторону образования сложного эфира, в щелочной среде равновесие смещается в сторону гидролиза. В присутствии щелочи, реакция распада протекает необратимо и называется омылением.