Лекция 2.
«Агрегатное состояние вещества»
1. Общая характеристика агрегатных состояний.
2. Газообразное состояние вещества.
3. Жидкое состояние.
4.Твердое состояние.
Значение и задачи физколлоидной химии (СР)
Общая характеристика агрегатных состояний
Все вещества во Вселенной в зависимости от расстояния между частицами, степени их взаимодействия, температуры и давления могут находиться в одном из четырех агрегатных состояний: твердом, жидком, газообразном или плазменном.
Четвертое агрегатное состояние открыл В. Крукс в 1879 году. Состояние плазмы возникает в том случае, если на вещество в газообразном состоянии действуют такие сильные ионизирующие факторы, как сверхвысокие температуры, мощные электрические разряды или электромагнитные излучения. При этом происходит разрушение молекул и атомов вещества и превращение его в смесь, состоящую из положительно заряженных ядер и электронов, движущихся с колоссальными скоростями. Свободно движущиеся электроны и ионы могут переносить электрический ток, поэтому плазма – это проводящий газ. В состоянии плазмы во Вселенной находится 99,9% вещества. Все звезды и пространство между ними состоят из плазмы.
Изменяя температуру и давление вещества, можно регулировать силы межмолекулярного взаимодействия и кинетическую энергию молекул и, тем самым, обеспечивать взаимопереходы между агрегатными состояниями.
Переход вещества из твердого состояния в жидкое называется плавлением, а из жидкого в газообразное – парообразованием. Обратные процессы называют затвердеванием и сжижением. Некоторые вещества (йод) могут переходить, непосредственно минуя жидкое, из твердого состояния в газообразное. Такой процесс называется сублимацией, а обратный – десублимацией. Все эти процессы, как правило, сопровождаются выделением теплоты.
Не все вещества могут находиться в трех состояниях - некоторые могут находиться в двух или в одном состоянии (карбонат кальция, белки, крахмалы, целлюлоза – только в твердом состоянии).
Газообразное состояние вещества
В газообразном состоянии частицы сильно удалены друг от друга и почти не взаимодействуют, в результате вещество обладает способностью расширяться и стремится занять весь предоставленный ему объем.
Основные газовые законы выведены для идеального газа – это модель реально не существующая в природе.
Идеальный газ – это газ, находящийся в таком состоянии, при котором можно пренебречь силами межмолекулярного взаимодействия и собственным объемом его молекул. Свойства идеального газа определяются Т и Р, при которых газ находится в данный момент.
В то же время создание модели обеспечивает получение фундаментальных уравнений, которые с поправками используются для описания широкого круга реальных систем.
Законы идеальных газов
1. Закон Бойля-Мариотта
1662 г. английский физик и химик Роберт Бойль опубликовал результаты исследования зависимости изменения объема воздуха от изменения давления:
Объем данной массы газа (V) при постоянной температуре
Изменяется обратно пропорционально давлению (Р),
под которым находится газ
 |
или P1V1 = P2V2. Аналогичное равенство можно написать и для других значений Р и V: P1V1 = P2V2 = P3V3 = const
В общем виде РV= const при условии, что Т= const
Если переход из состояния 1 в состояние 2 происходит при постоянной Т, такой процесс называется изотермическим.
Т.о., произведение объема газа на его давление при постоянной температуре есть величина постоянная.
Независимо и одновременно этот закон открыл французский физик Э.Мариотт.
2. Закон Шарля
Если переход из состояния 1 в состояние 2 осуществляется при постоянном давлении, такой процесс называется изобарным.
1787 г. Шарль на основе длительных наблюдений сделал вывод, что при постоянном давлении объем данной массы газа линейно изменяется с температурой:
 отношение объема к абсолютной температуре при постоянном давлении постоянно
отношение объема к абсолютной температуре при постоянном давлении постоянно
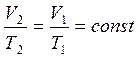 |
3. Закон Гей-Люссака
Французский химик и физик Гей-Люссак в 1808 г. установил закон изменения давления в зависимости от температуры (при изохорных условиях):