Оксиды
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.

Например: CaO – оксид кальция, K2O – оксид калия, Al2O3 – оксид алюминия. А если элемент имеет несколько степеней окисления или переменную валентность, то после названия оксида в скобках римскими цифрами указывают численное значение степени окисления. Например: Fe2O3 – оксид железа (III), CuO – оксид меди (II), CrO3 – оксид хрома (VI).
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
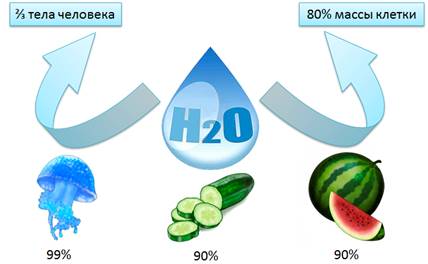
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
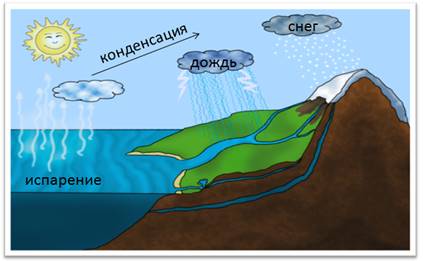
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
|
|
Круговорот воды в природе
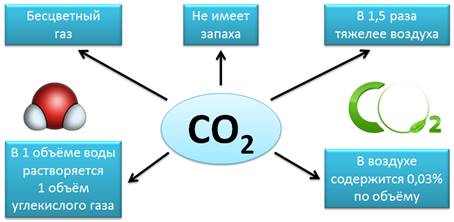
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а твердый диоксид углерода, или «сухой лед» используют для хранения продуктов питания, в частности мороженого. Т.к. углекислый газ не поддерживает горение, его используют для тушения пожаров. В медицине углекислый газ используют для углекислотных ванн.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
|
|
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.
По агрегатному состоянию оксиды бывают жидкими, примером такого оксида является вода, или оксид водорода, примером твердого оксида является уже известный вам оксид кремния (IV), или песок, а также различные разновидности кварца; примером газообразных оксидов являются углекислый газ, или оксид углерода (IV), а также угарный газ, или оксид углерода (II).

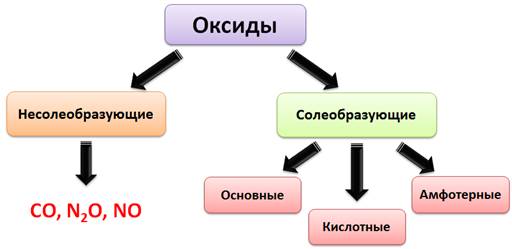
По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Несолеобразующие оксиды не реагируют с кислотами и основаниями, а также не образуют солей. К несолеобразующим оксидам относятся такие оксиды, как оксид углерода (II) – CO, оксид азота (I) – N2O и оксид азота (II) – NO. К солеобразующим оксидам относятся основные, амфотерные и кислотные.
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов I и II A группы, а также оксиды металлов с небольшими степенями окисления (+1, +2). Кроме того, все основные оксиды являются твёрдыми веществами. Например, оксид магния (MgO) – это основный оксид, потому что магний – металл II A группы, ему соответствует основание Mg(OH)2. CrO – тоже основный оксид, т.к. у хрома степень окисления в данном случае +2, этому оксиду соответствует основание – Cr(OH)2. Na2O – основный оксид, т.к. натрий – металл I A группы, ему соответствует основание NaOH.
|
|

Основные оксиды вступают в реакции обмена с кислотами. При этом образуется соль и вода. Для того чтобы в этом убедиться, проведём эксперимент: поместим в пробирку немного порошка оксида меди (II), как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает растворяться. Чтобы убедиться в том, что в результате реакции образуется соль, несколько капель содержимого пробирки поместим на предметное стекло и выпарим, после чего на стекле появляются кристаллы соли.


CuO + H2SO4 = CuSO4 + H2O
Основные оксиды вступают в реакции соединения с кислотными оксидами, при этом образуются соли. Например, при взаимодействии оксида натрия с оксидом фосфора (V) образуется соль – фосфат натрия, в результате взаимодействия оксида магния с оксидом серы (VI) образуется соль – сульфат магния, а при взаимодействии оксида кальция с оксидом углерода (IV) образуется соль – карбонат кальция.

3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
Основные оксиды вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт. Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
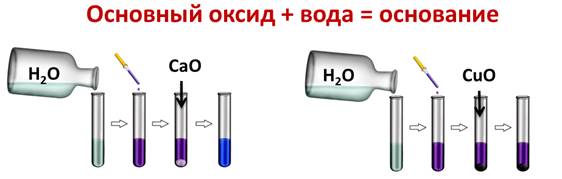
CaO + H2O = Ca(OH)2
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов с большими степенями окислени я. Например, оксиду азота (V) соответствует азотная кислота, оксиду фосфора (V) – фосфорная кислота, оксиду серы (IV) – сернистая кислота, оксиду серы (VI) – серная кислота, оксиду кремния (IV) – кремниевая кислота, оксиду углерода (IV) – угольная кислота, оксиду хрома (VI) – хромовая кислота, оксиду марганца (VII) – марганцевая кислота.
N2O5 → HNO3
P2O5 → H3PO4
SO2 → H2SO3
SO3 → H2SO4
SiO2 → H2SiO3
CO2 → H2CO3
CrO3 → H2CrO4
Mn2O7 → HMnO4
Кислотные оксиды вступают в реакции обмена с основаниями, при этом образуется соль и вода. Если через пробирку с известковой водой пропустить углекислый газ, то известковая вода мутнеет, следствие образования соли – карбоната кальция.
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Кислотные оксиды вступают в реакции соединения с основными оксидами, при этом образуются соли. Например, в результате взаимодействия оксида серы (IV) и оксида калия образуется соль – сульфит калия, в результате взаимодействия оксида кремния (IV) с оксидом натрия при нагревании, образуется соль – силикат натрия, при взаимодействии оксида азота (V) с оксидом бария, образуется соль – нитрат бария.

SO2 + K2O = K2SO3
SiO2 + Na2O = Na2SiO3
N2O5 + BaO = Ba(NO3)2
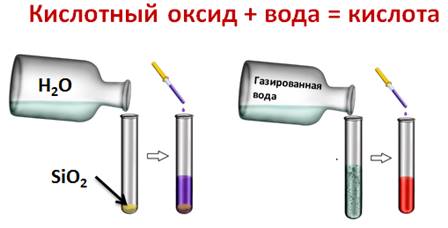
Кроме этого, кислотные оксиды вступают в реакции соединения с водой, при этом образуются кислоты, однако эти реакции возможные, если оксид растворим в воде. Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в другую – раствор углекислого газа (газированной воды). В первую пробирку добавим оксида кремния (IV). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) не растворим в воде.