Кл. ХИМИЯ. 16.04.2020. Кейс №4
Тема урока: Непредельные углеводороды. Ацетилен,
Цель: Познакомить учащихся с изомерией, номенклатурой алкинов, рассмотреть способы получения ацетилена, рассмотреть химические свойства ацетилена: реакции присоединения, горения.
Ход урока
1. Организационный момент. Здравствуйте, ребята!
Сегодня на уроке мы продолжим изучать большую тему “Углеводороды”, будем знакомиться с новым классом соединений, изучим особенности их строения, номенклатуру, изомерию, конечно, свойства и получение его типичного представителя.
Запишите в тетрадях число и тему.
II.Проверка знаний
Предлагаю ученикам блиц-опрос по пройденному материалу
1. Что изучает органическая химия
2. Из атомов каких химических элементов чаще всего состоят органические вещества
3. Какие классы органических соединений мы изучили
4.Какую валентность проявляет углерод в органических веществах
5. Что такое предельные УВ? Как их еще называют?
6. Общая формула класса
7. Назовите 10 представителей класса
8. Чем алкены отличаются от алканов?
9. Общая формула класса
10. Назовите 5 представителей данного класса
III. Изучение нового материала.
История открытия
Этот газ был открыт Гемфри Дэви в 1836 году в продуктах разложения метана, под действием искровых электрических разрядов
В 1860 г. МарселенБертло синтезировал его из простых веществ, пропуская водород через электрическую дугу между угольными электродами.
Но, проще всего к этому вопросу подошел в 1862 г. Фридрих Велер. Он получил этот газ из карбида кальция, действуя на него водой. Вскоре его опыт стали использовать в …. фонарных столбах.
В фонарь, наполненный карбидом кальция, по каплям поступала вода, а получившийся газ поступал в горелку и использовался для освещения.
Что же за газ такой получил Велер?
Запись в тетради:
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H.
Алкины – это непредельные углеводороды с одной тройной углерод-углеродной связью в цепи и общей формулой СnH2n-2
Строение

sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H


Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
Запомните!
1. Длина связи 0,12 нм
2. Угол 180
3. Линейная молекула
4. Связи – σ и 2π
5. Sp- гибридизация


Физические свойства
С2Н2 – газ без цвета и почти без запаха, технический ацетилен обладает неприятным запахом, легче воздуха, мало растворим в воде. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы.
При обычных условиях алкины С2Н2 - С4Н6 – газы, С5Н8 - С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях.
Свойства гомологов изменяются аналогично алкенам.
5. Изомерия и номенклатура Запись в тетради подчеркнутого названия формул и реакций:
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):

2. Изомерия углеродного скелета (начиная с С5Н8):

3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:

Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом - вдоль линии связи.
Химические свойства алкинов
I. Реакции присоединения
1). Галогенирование – стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
3 ). Гидратация – (р. М.Г. Кучерова)
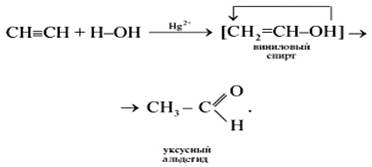
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
1). Горение – пламя сильно коптящее
Получение
В лаборатории:из карбида кальция гидролизом (взаимодействие с водой)
CaC2 + 2H2O → Ca(OH)2 + H-C≡C-H
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен -кислородной сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.