Методические указания к выполнению
Внеаудиторной самостоятельной работы № 3
Тема: 1.3. Строение вещества.
Учебно-методическое и информационное обеспечение:
Основные источники:
1. Учебно-методическое пособие по химии для студентов 1 курса, глава 1.3.
2. Рудзитис Г.Е., Фельдман Ф.Г. Химия: учебник для 11 кл. - М. Просвещение, 2017, гл.II
3. Химия. 10 класс. Углубленный уровень: учебник / Еремин В.В., Кузьменко Н.Е., Теренин В.И., Дроздов А.А., Лунин В.В., М., Дрофа, 2014., стр.26-32.
4. Химия. 11 класс. Углубленный уровень: учебник / Еремин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В., М., Дрофа, 2014., стр.245-263.
Интернет-ресурсы:
1. Образовательный ресурс по химии «Алхимик» https://www.alhimik.ru/
2. Видео уроки по химии URL https://www.videouroki. net/filecom.php? fileid=98665112
3. Интерактивный учебник по химии Центра онлайн-обучения «Фоксфорд» https://www.youtube.com/watch?v=NpBpWmsJz_w&list=PL66kIi3dt8A6oBVusRR98vfkbuKxR5UgC
Требования к оформлению работы: (см. Указания по выполнению внеаудиторной самостоятельной работы)
Студент должен знать:
- важнейшие понятия: атом, ион, молекула, химический элемент, валентность, степень окисления, химическая связь, σ- и π- связи, ковалентная связь, полярная и неполярная связь, электроотрицательность, ионная связь, металлическая связь, водородная связь, кристаллическая решетка; ОВР, окислитель и восстановитель, реакции окисления и восстановления, электролиз;
- механизм образования ковалентной связи (обменный и донорно-акцепторный), как образуется σ- и π- связь, понятие «кратность связи», от чего зависит полярность ковалентной связи, для каких элементов характерно образование ковалентной связи;
- правила составления электронных и структурных формул ковалентных соединений и схем образования ковалентных связей;
- типы кристаллических решеток, которые могут образовывать вещества с ковалентной связи (атомная и молекулярная), физические свойства веществ с данным видом решетки;
- механизм образования ионной связи, за счет чего она осуществляется, между какими элементами она образуется, чем похожа и чем отличается от ковалентной связи; кристаллическая ионная решетка: частицы, которые ее образуют, взаимодействие между ними, прочность решетки, свойства веществ, имеющих ионное строение;
- образование связи в простых веществах металлах, особенности строения кристаллической решетки металлов и металлической связи, общие физические свойства металлов, обусловленные металлической связью;
- знать за счет чего образуется водородная связь внутри молекулы и между молекулами, относительную прочность водородной связи, межмолекулярное взаимодействие (силы Ван-дер-Ваальса);
- правила определения степени окисления в соединениях;
- алгоритма расстановки коэффициентов в ОВР методом электронного баланса, роль ОВР в природе и обмене веществ человека;
- понятие электродного потенциала как количественной характеристики ОВ процесса, понятие гальванических пар, суть процесса электролиза и использование этого процесса на практике;
Студент должен уметь:
- правильно использовать основные понятия теории строения вещества при ответах;
- определять наличие ковалентной связи в соединении, её полярность, кратность, наличие σ- и π- связи, механизм образования, оценивать прочность связи;
- составлять схемы образования ковалентной связи, записывать структурные формулы ковалентных соединений, обозначать полярность и кратность связи;
- определять тип кристаллической решетки, описывать физические свойства веществ с молекулярной и атомной решеткой, приводить примеры таких веществ;
- условно обозначать ионы и писать для них электронные формулы; рисовать схему образования ионов и ионной связи, обозначать заряды ионов, объяснять сходство и различие ионной связи и ковалентной, описывать физические свойства веществ с ионной решеткой, оценивать ее прочность в зависимости от заряда ионов;
- объяснять общие физические свойства металлов на основании строения кристаллической решетки и особенностей образования металлической связи;
- объяснять появление водородной связи в веществах, и изменения физических свойств, которые из-за этого происходят, приводить примеры веществ с внутримолекулярной и межмолекулярной водородной связью;
- определять степени окисления в соединениях, составлять формулы веществ с определенной степенью окисления и называть их;
- определять является ли реакция ОВР, определять какой из элементов является окислителем, а какой восстановителем, сколько электронов теряет или при приобретает элемент при изменении степени окисления элемента, расставлять коэффициенты в ОВР методом электронного баланса;
- научиться пользоваться рядом стандартных электродных потенциалов для понимания возможности протекания ОВР;
- записывать простейшие реакции, проходящие в гальванических элементах и при электролизе расплавов и растворов солей.
Виды самостоятельной работы студентов:
1. Составление словаря терминов
2. Ответы на вопросы и выполнение упражнений
Вопросы и содержание материала для самостоятельного изучения,
алгоритм выполнения самостоятельной работы:
I. Составить словарь терминов и выучить их:
химическая связь, ковалентная связь, σ- и π- связи, одинарная и кратная (двойная и тройная) связь, полярная и неполярная связь ковалентная связь, свободно-радикальный и ионный разрыв связи, ионная связь, металлическая связь, водородная связь, кристаллическая решетка, окислительно-восстановительная реакция, окислитель, восстановитель, процесс окисления, процесс восстановления, электродный потенциал, гальваническая пара, электролиз.
II. Ответьте на вопросы и выполните упражнения
№1 Почему атомы большинства химических элементов склонны вступать в химические реакции и образовывать простые и сложные вещества?
№2 Что такое химическая связь? Какие виды связи бывают?
№3 Какая связь называется ковалентной? Для каких веществ она характерна? За счет чего образуется эта связь? Приведите примеры.
№4 Чем похожи и чем отличаются ковалентная полярная и ковалентная неполярная связь? Может ли существовать в одной молекуле разные виды ковалентных связей?
№5 Чем похожи и чем отличаются π- и σ –связи ковалентные связи? Какая из них более прочная? Когда связь называют «кратной»?
№6 Какая связь называется ионной? Для каких веществ она характерна? За счет чего образуется ионная связь? Почему ее называют «нелокализованной»? Приведите примеры образования ионной связи.
№7 Какая химическая связь характерна для металлов? За счет чего она образуется? Чем она похожа на ковалентную неполярную связь? Чем она похожа на ионную связь? Какая кристаллическая решетка образуется веществами с металлической связью?
№8 Какие виды кристаллических решеток вам известны? Какая решетка образуется веществами с ковалентной связью? Какая решетка образуется веществами с ионной связью? Какая из них самая прочная? Какая решетка самая непрочная? Почему?
№9 От чего зависит степень окисления элементов? Какие правила используют для вычисления степени окисления элементов в сложном соединении?
№10 Что такое окислители и восстановители? От чего зависят окислительные и восстановительные способности атомов элементов?
№11 Распределите вещества на четыре группы, по видам химической связи, поясните свой выбор:
Na, N2, P2O5, NH3, Fe2O3, CaCl2, Cu, P4, CS2, Na3N, H2O, C, Zn, HF
№12 Запишите схему образования молекул, укажите тип связи:
Br2, HCl, H2O, O2, KCl, Na2S
№13 Какая кристаллическая решетка будет: а) у нафталина, б) у воды, в) у хрома, г) алмаза, д) у поваренной соли? Ответ поясните.
№14 Определить степень окисления всех элементов входящих в состав соединений: H2, MgCl2, N2O3, Al2(SO4)3, Na2O, Ca, O2, Al2O3, H3P, Ba(NO3)2. Помните, что сумма степеней окисления всех атомов в сложном веществе равна нулю, а в ионе – заряду иона. Алгоритм вычисления степени окисления аналогичен алгоритму вычисления валентности. Постоянную степень окисления имеют те же элементы, которые имели постоянную валентность, причем по модулю эти величины совпадают. Отрицательную степень окисления элемента (она может быть только у неметаллов и только одна!), всегда можно определить по ПС.
№15 Укажите количество электронов, отданных или присоединенных элементами. Какой процесс - окисления или восстановления отражает схема?
а) Cu+2…..=>Cu0;
б) Cl-…..=>Cl0;
в) N-3…..=>N+2.
№16. Определите степень окисления хрома в соединениях. В каких из них для хрома характерны свойства только восстановителя? В каких - только окислителя? Ответ поясните.
Cr2O3 , Na2CrO4, CrCl2, CrSO4, K2Cr2O7, Cr
№17.
Пользуясь алгоритмом расставьте коэффициенты в ОВР методом электронного баланса.
а) Fe2O3 + CO  Fe + CO2.
Fe + CO2.
б) NO + O2  NO2.
NO2.
в) K2S + HNO3 = KNO3 + S + NO2 + H2O
г) Cu2O + HNO3 = Cu(NO3)2 + NO + H2O
д) KI +KMnO4 + H2SO4 = I2 +MnSO4 + K2SO4 + H2O
Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса.
1. Запишите схему реакции (формулы исходных веществ и продуктов реакции)
2. Определите степени окисления элементов до и после реакции
3. Выписать элементы степени окисления которых изменились (простые вещества выписываются с индексами).
4. Определить, сколько отдал или принял элемент электронов (помните, что электроны имеют отрицательный заряд).
5. Количество электронов с участием простых веществ умножается на индекс и перед ионом выставляется коэффициент равный индексу.
6. Определите окислитель и восстановитель (окислитель принимает электроны и его степень окисления понижается, восстановитель отдает электроны, его степень окисления повышается).
7. Выписать количество электронов для окислителя и восстановителя, найти для этих чисел наименьшее общее кратное.
8. Определить коэффициенты разделив поочередно наименьшее общее кратное на количество электронов.
 9. Полученные коэффициенты поставить в правой части уравнения перед теми элементами напротив которых они стоят в окислительно-восстановительном балансе.
9. Полученные коэффициенты поставить в правой части уравнения перед теми элементами напротив которых они стоят в окислительно-восстановительном балансе.
10. Уравнять правую и левую части уравнения (проверить по элементам, которые не меняли степени окисления).
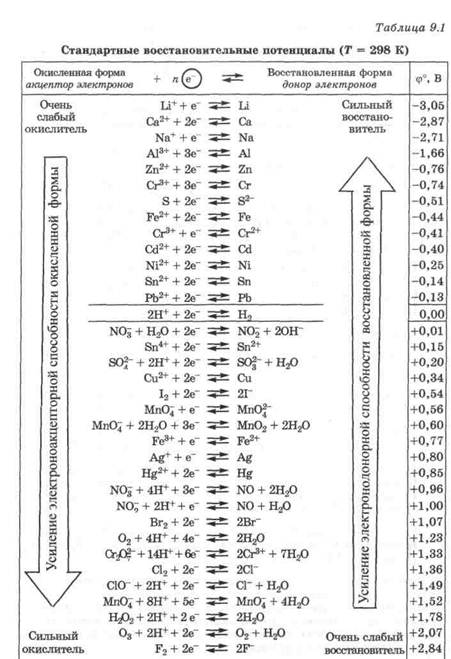
№18. Какие из ОВ реакций будут проходить, а какие нет? Почему? Запишите возможные уравнения реакций, укажите окислитель и восстановитель. Для ответа на вопрос воспользуйтесь таблицей стандартных электродных потенциалов.
А) AlCl3 + Sn →
Б) CuSO4 + Zn →
В) KCl + Br2 →
Г) NaI + Cl2 →
№19. Составьте уравнения реакций, которые протекают при электролизе расплава бромида калия на инертных электродах (на катоде, на аноде и общее уравнение процесса).
№20. В каком степени окисления в организме человека находится важнейший микроэлемент марганец? Почему? Какую роль в ОВР обычно выполняет вещество KMnО4? Почему? Как называют и для чего используют это соединение в медицине?