
|  Вещества Вещества
| |||||
 Гетерогенные смеси
вода и масло Гетерогенные смеси
вода и масло
|  Физические методы разделения Физические методы разделения
|  Гомогенные вещества
вода и NaCl Гомогенные вещества
вода и NaCl
| ||||
Растворы
 вода и NaCl вода и NaCl
|  Физические методы разделения Физические методы разделения
| Чистые вещества
H2O
| ||||
| Химические соединения H2O | Химические
 реакции
реакции
| Элементы H2 и О2 |
Прикладной вопрос химии соединений – это разработка новых химических технологий, синтез новых веществ:
Например, фторуглероды – новые органические вещества, устойчивые в агрессивных средах (кислотах, щелочах) и обладающие особой поверхностной активностью (способны поглощать кислород и перекиси). Из фторуглеродов сейчас изготавливают сердечные клапаны и кровеносные сосуды человека.
3. Проблемы структуры химического соединения
Сейчас существует особое направление – структурная химия. В её задачи входит создание структурных формул любых химических соединений и разработка возможностей для целенаправленного качественного преобразования веществ, для создания схемы синтеза любого химического соединения.
Развитие этого направления в химии тесно связано с именем русского химика Александра Михайловича Бутлерова. Его теория позволяла строить структурные формулы любого химического соединения, т.к. показывала взаимное влияние атомов в составе молекулы. Эта теория стала для химиков практическим руководством по синтезу органических веществ. → Химия из аналитической науки (изучала состав готовых веществ) стала наукой синтетической (способной создавать новые вещества).
Эта теория наглядно показала валентность химических элементов, как число единиц сродства, присущих атому → можно комбинировать атомы ХЭ, учитывая их единицы сродства → появилась возможность создавать структурные формулы любых химических соединений:

 Н Н Н
Н Н Н


 Н – С – С – С – О – Н (С3Н7ОН – пропанол)
Н – С – С – С – О – Н (С3Н7ОН – пропанол)
 Н Н Н
Н Н Н
Появилось понятие изомерии – т.е. существование веществ, имеющих один и тот же качественный и количественный состав, одинаковую молекулярную массу, но отличающихся друг от друга строением, а следовательно и свойствами.
С5Н12 (пентан):
 СН3 – СН2 – СН2 – СН2 – СН3, или СН3 – СН – СН2 – СН3
СН3 – СН2 – СН2 – СН2 – СН3, или СН3 – СН – СН2 – СН3
СН3
Как результат возникновения структурной химии – возник органический синтез (60-е – 80-е гг. 19 века). Сейчас – большая часть лекарственных препаратов – это продукты органического синтеза.
Исследования в области современной структурной химии идут по двум направлениям:
· Синтез кристаллов с максимальным приближением к идеальной решетке → получение материалов с высокими техническими показателями (прочностью, устойчивостью, долговечностью).
Сложность – для выращивания таких кристаллов необходимо исключить воздействие всех внешних факторов (даже земного притяжения) → такие кристаллы выращивают на орбитальных станциях в космосе;
· Создание кристаллов с заранее запрограммированными дефектами → производство материалов с заданными электрическими, магнитными и другими свойствами, которые основываются на этих дефектах.
Сложность – вместе с запрограммированными дефектами обычно появляются и нежелательные.
4. Проблемы химического процесса.
Эта проблема встала перед учеными - химиками после того как было доказано, что на способность химических веществ к взаимодействию могут влиять и условия протекания химических реакций.
Изучением химических процессов и условий их протекания занимались такие великие химики как Г.И. Гесс, Я. Вант-Гофф, Ле-Шателье и др. Одним из основоположников учения о химических процессах стал и русский химик Николай Николаевич Семенов – лауреат Нобелевской премии 1965 г.
Условия, влияющие на ход химических реакций:
· Термодинамические условия (температура, давление и т.п.) – влияют на направленность химических процессов.
 Каждая химическая реакция в принципе обратима, но на практике равновесие может смещаться в ту или иную сторону. Есть реакции, которые не требуют особых средств управления (реакции нейтрализации, реакции с образованием газообразного вещества или твердого осадка). Они протекают как прямые и необратимые реакции:
Каждая химическая реакция в принципе обратима, но на практике равновесие может смещаться в ту или иную сторону. Есть реакции, которые не требуют особых средств управления (реакции нейтрализации, реакции с образованием газообразного вещества или твердого осадка). Они протекают как прямые и необратимые реакции:
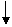 BaCl2 + H2SO4 = BaSO4 + 2HCl, или Na2S + H2SO3 = Na2SO3 + H2S
BaCl2 + H2SO4 = BaSO4 + 2HCl, или Na2S + H2SO3 = Na2SO3 + H2S
Но существуют реакции, равновесие которых смещено влево, к исходным веществам. И чтобы их осуществить, требуются особые термодинамические условия – увеличение температуры, давления и концентрации реагируемых веществ:
T t
H2CO3 + MgO = MgCO3 + H2O, или Ba(OH)2 = BaO + H2O
Термодинамическое воздействие влияет только на направление химического процесса, а не на его скорость.
· Кинетические условия ( строение исходных реагентов, их концентрация, наличие катализаторов или ингибиторов и т.п.) - влияют на скорость химических процессов.
В большинстве случаев на скорость химических реакций влияют катализаторы (ускоряют процесс) или ингибиторы (замедляют процесс). Сами эти вещества хотя и участвуют в реакции, но в конце ее выделяются в неизменном виде.
Например, реакция разложения бертолетовой соли, или взаимодействие аммиака с кислородом:
MnO2 Pt
2KClO3 = 2KCl + 3O2, или 4NH3 + 5O2 = 4NO + 6H2O
Суть катализа в том, что сначала:
Ø Реагирующие вещества вступают в контакт с катализатором, взаимодействуют с ним, в результате чего происходит ослабление химических связей;
Ø Затем происходит перераспределение ослабленных химических связей в результате чего получаются новые вещества, а катализатор выходит из реакции в таком же состояние, как и до неё;
Ø Следствием взаимодействия реагентов с катализатором является увеличение скорости реакции, так как на поверхности катализатора молекулы реагирующих веществ чаще встречаются.
На современном этапе в рамках учения о химических процессах разрабатывается целый ряд актуальных вопросов. Это
¨ Химия плазмы.
Изучает химические процессы в низкотемпературной плазме (плазма – это ионизированный газ). Такие реакции происходят с огромной скоростью (10-13 сек) при температуре от 1000 до 10 000 0С. Производительность плазмохимических процессов очень высока.
Сейчас химия плазмы внедряется и в промышленное производство – уже созданы плазменные сталеплавильные печи, позволяющие получать самые высококачественные металлы. Плазмохимия позволяет синтезировать новые ранее неизвестные материалы, такие как металлобетон, превосходящий по своим техническим качествам обычный бетон в десятки и сотни раз.
¨ Радиационная химия.
Изучает превращения самых разных веществ под воздействием ионизирующих излучений. Источниками этих излучений служат рентгеновские установки, ускорители заряженных частиц и ядерные реакторы. В результате радиационно-химических реакций вещества получают повышенную термостойкость и твердость.
Наиболее важными направлениями радиационно-химической технологии являются полимеризация, вулканизация, производство композиционных материалов (полимербетон – в 4 раза более прочный, водонепроницаемый, устойчив к коррозии).
¨ Химия высоких давлений и температур.
Основная цель этого направления – высокотемпературный синтез тугоплавких и керамических материалов. Это производство основано на реакциях горения одного металла в другом, или металла в азоте, углероде и т.п.
Горение – это реакция окисления. Горение возможно не только в кислороде, но и в других окислителях. Таким образом, происходит горение порошка титана в порошке бора, или порошка циркония в порошке кремния. В результате таких реакций получают тугоплавкие соединения самого высокого качества.
5. Проблемы эволюционной химии.
До 50 – 60-х годов ХХ века об эволюционной химии еще ничего не было известно. Химиков вопрос о происхождении вещества не волновал, т.к. получение любого нового химического соединения было делом рук и разума человека. Молекулу нового вещества можно построить по законам структурной химии из атомов, как здание из кирпичей.
Возникновению эволюционной химии способствовали исследования в области биокатализаторов (химия ферментов). В этом случае искусственный выбор катализаторов ориентировался на естественную, происходящую в природе эволюцию от неорганических веществ к живым системам.
Сейчас эволюционная химия решает проблемы самопроизвольного ( без участия человека ) синтеза новых химических соединений, являющихся более высокоорганизованными продуктами по сравнению с исходными веществами.
Эволюционная химия – это наука о самоорганизации и саморазвитии
химических систем.
В процессе самоорганизации живых систем происходил определенный отбор химических элементов:
· Из всех химических элементов на Земле наиболее распространены О и Н, а в космосе Н и Не.
· В настоящее время насчитывается около 8 млн. химических соединений. Из них 96% - органические. Они состоят из 6 - 18 элементов.
Из остальных 95 элементов природа создала только 300 тыс. неорганических соединений.
· Основу всех органических соединений, а следовательно, и всех живых систем составляют 6 элементов (органогенов). Это C, H, O, N, P и S. Их общая доля в организме – более 97%.
· За ними следуют 11 элементов, которые принимают участие в построении многих физиологически важных компонентов биосистем. Это Na, K, Ca, Mg, Fe, Si, Al, Cl, Cu, Zn и Co. Их общая доля в организме – 1,6%.
· Еще 20 элементов участвуют в построении и функционировании отдельных узкоспециализированных биосистем. Их суммарная доля – 1%.
· Все остальные элементы в построении биосистем практически не участвуют.
Определяющими критериями в отборе химических элементов при формировании биологических систем являются:
Ø Способность образовывать прочные и энергоёмкие химические связи;
Ø Эти химические связи должны быть лабильны (т.е. способны к образованию новых разнообразных связей).
è Элемент № 1 – это углерод (С). Он лучше других элементов соответствует этим критериям.
В настоящее время все процессы, происходящие в живом организме можно изложить на языке химии, в виде конкретных химических процессов.
