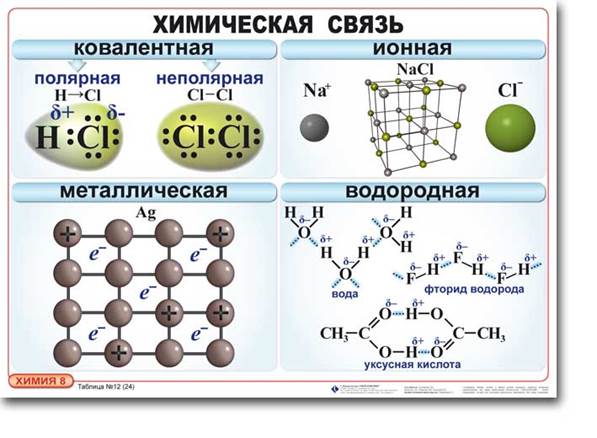
В чем сходство и различия между металлической связью и ковалентной?
Между металлической и ионной?
- сходство с ковалентной: валентные электроны находятся в общем пользовании, но в случае ковалентной в общем пользовании только двух атомов, а в случае металлической связи эти электроны связывают все атомы куска металла, создают "электронный газ".
- c ионной связью металлическая сходна наличием ионов, но в металлической положительные ионы удерживаются "электронным газом", а в ионной - положительными и отрицательными ионами (валентные электроны находятся в общем пользовании "электронный газ")
Вспомним "Типы кристаллических решеток":
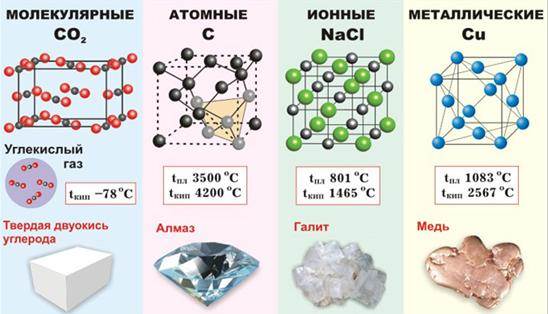
Особенности металлической кристаллической решетки
Благодаря притяжению всех свободных электронов всеми положительными ионами металлическая связь очень прочна, поэтому для металлов характерны кристаллические решетки с плотной упаковкой ионов:
гексагональная (цинк, магний),
кубическая гранецентрированная (медь, серебро, алюминий)
и менее плотная - кубическая объемноцентрированная (железо, натрий, барий).
Итак, металл - это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами.
Рассмотрите образцы металлов и назовите, какими общими физическими свойствами они обладают?
Коллекция металлов
Общие свойства:
электропроводность,
теплопроводность,
металлический блеск,
твердость,
пластичность.
Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
- причина в особенностях металлической связи, структуре кристаллов металлического типа.
Рассмотрим общие физические свойства металлов:
теплопроводность и электропроводность
Действительно, электрическая проводимость металлов объясняется движением свободных электронов.
Почему при нагревании электрическая проводимость металлов уменьшается?
Чем обусловлена теплопроводность, и как она изменяется при нагревании?
Изменение теплопроводности и электропроводности при нагревании или охлаждении
Пластичность - способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов?
В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности - также особое строение кристаллической решетки.
Металлический блеск также обусловлен особым строением металлов (благодаря свободным электронам металлы хорошо отражают световые лучи).
Да, металлы обладают общими физическими свойствами, которые обусловлены их особым строением, но у разных металлов степень проявления каждого свойства различна.
Так, лучшей электропроводностью обладает серебро, на втором месте - медь, а на третьем - золото.
Такие различия в проявлении физических свойств связаны с тем, как плотно упакованы ионы в кристаллической решетке металла, каковы их размеры и сколько валентных электронов у каждого атома обобществляется.
Например, чем большее число атомов металла находиться в единице объема металла, тем большей плотностью он будет обладать. Наиболее плотная упаковка ионов в кристаллах гексагонального вида. Однако плотность вещества зависит не только от вида кристаллической решетки, но и от массы составляющих его ионов и от их радиусов. Поэтому наименьшей плотностью обладают щелочные металлы. Самый тяжелый из всех металлов - осмий.
Если металлы образуют кристаллы одного вида (например, щелочные металлы), то возрастание плотности по ряду от лития до цезия объясняется увеличением их атомных масс и масс образуемых ионов, т.к. массы возрастают в большей степени, чем атомные радиусы. Если металлы образуют кристаллы разного вида, то закономерность более сложная, и ее описанием занимается больше физика, чем химия.
В зависимости от плотности металлы принято делить на легкие (их плотность менее 5 г/см3) и тяжелые (их плотность более 5 г/см3).
Так у алюминия плотность - 2, 7 г/см3- металл легкий.
Пластичность металлов также зависит от вида кристалла и от количества связывающих электронов, от размеров ионов.
Самый пластичный - золото. Кусочек золота величиной со спичечную головку можно расплющить в просвечивающий голубовато-зеленым светом лист площадью 50 квадратных метров. Образец золота весом 1г можно протянуть в проволоку длиной 2 км. Исстари на Руси выделывали "сусальное золото": сначала его прокатывали в вальцах до толщины листа писчей бумаги, затем укладывали между тонкими пленками, снятыми со слепой кишки коровы и прокатывали на наковальне деревянными молоточками. Повторяя эту операцию неоднократно, получали листочки золота толщиной всего в десятую долю микрона, т.е. 500 атомов. "Сусальное золото" шло на покрытие деревянных предметов, кожи и т.п.
Самые хрупкие металлы V, VI, VII групп. У них от 5 до 7 валентных электронов, следовательно, очень крепкая связь ионов между собой, что препятствует их скольжению друг относительно друга, снижает пластичность. Этим же объясняется их тугоплавкость и твердость.
Чем меньше количество свободных электронов, чем больше размеры ионов, чем слабее связи ионов, тем мягче металлы. Самые мягкие - щелочные металлы, самый твердый - хром.
Температуры плавления металлов изменяются в очень широких пределах: от минус 39°С до 34100С у вольфрама. Ртуть единственный жидкий при обычных условиях металл.
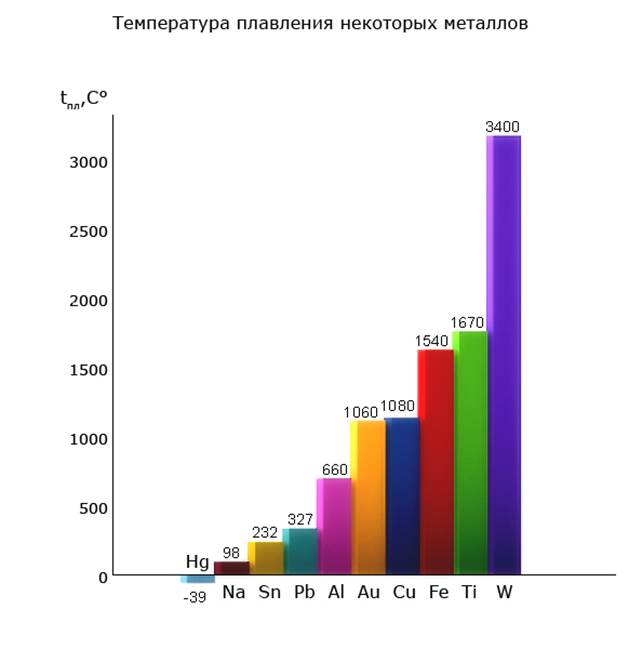
Таким образом, степень проявления физических свойств у разных металлов зависит не только от количества валентных электронов, но и от вида кристаллической решетки, размеров атомов и ионов, т.е. причины проявления металлами физических свойств многообразны.
Так как разные металлы имеют сходные металлические связи, а в ряде случаев образуют сходные металлические кристаллы, то многие из них при переходе в расплавленное состояние могут смешиваться друг с другом и образовывать сплавы. Сплавы могут образовывать и атомы металлов с неметаллами.
Сплавы обладают другими, более разнообразными свойствами, по сравнению с металлами в них входящими. Так, медь, олово и цинк - мягкие металлы, сплав же на их основе - бронза - очень твердый. Третник - сплав олова со свинцом используют при паянии, т.к. он имеет низкую температуру плавления. Наиболее распространенные сплавы металла и неметалла - чугун и сталь.
Более подробно мы познакомимся со сплавами на последующих уроках.
Контрольно-тренировочные материалы
Положение в ПСХЭ Д.И. Менделеева металлов и неметаллов Гиперссылка
https://files.school-collection.edu.ru/dlrstore/0ab8f178-4185-11db-b0de-0800200c9a66/x9_008.swf
Металлы и не металлы
https://LearningApps.org/view58290