Тема 1.2 «Строение атома. Периодический закон»
Теория.
1. Состав атома. Модель строения атома.
2. Состояние электронов в атоме.
3. Строение электронных оболочек атомов 1-4 периодов.
4. Зависимость свойств элементов от электронной конфигурации. Электроотрицательность. Металлические и неметаллические свойства. Степень окисления и валентность элементов.
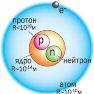 Атом – мельчайшая химически неделимая частица, но эта частица имеет сложное строение. В 1911 г. Резерфордом была предложена планетарная модель строения атома. Чуть позже – в 1913 г теория Бора. Суть их теорий можно сформулировать так:
Атом – мельчайшая химически неделимая частица, но эта частица имеет сложное строение. В 1911 г. Резерфордом была предложена планетарная модель строения атома. Чуть позже – в 1913 г теория Бора. Суть их теорий можно сформулировать так:
В центре атома находится положительное ядро, занимающее ничтожную часть пространства атома. Вокруг ядра двигаются электроны, они образуют т.н. электронную оболочку. Их общий заряд равен заряду ядра атома, но с противоположным знаком. Разные виды атомов с определенным массовым числом и определенным порядковым номером называют нуклидами.
Ядро состоит из протонов и нейтронов. В ядре сосредоточена почти вся масса атома (масса протона 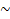 1 а.е.м., масса нейтрона
1 а.е.м., масса нейтрона  1 а.е.м., масса электрона = 1/1823 а.е.м.). Число протонов называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента, потому что именно сумма протонов и нейтронов определяет массу атома. Протоны и нейтроны иногда называют нуклонами, а массовое число нуклонным. Порядковый номер (протонное число) и массовое число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такую совокупность атомов называют изотопами. Это разновидности химического элемента. Они имеют одинаковые химические свойства. Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число, мы можем вычислить среднюю атомную массу элемента. Т.к. заряд ядра равен заряду электронной оболочки, а у каждого электрона заряд (-1), то число протонов равно числу электронов.
1 а.е.м., масса электрона = 1/1823 а.е.м.). Число протонов называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента, потому что именно сумма протонов и нейтронов определяет массу атома. Протоны и нейтроны иногда называют нуклонами, а массовое число нуклонным. Порядковый номер (протонное число) и массовое число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такую совокупность атомов называют изотопами. Это разновидности химического элемента. Они имеют одинаковые химические свойства. Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число, мы можем вычислить среднюю атомную массу элемента. Т.к. заряд ядра равен заряду электронной оболочки, а у каждого электрона заряд (-1), то число протонов равно числу электронов.
Эти электроны двигаются по определенным орбитам вокруг ядра. Эта модель атома, предложенная Резерфордом, очень наглядна и полезна. Но сразу возник вопрос. Согласно электромагнитной теории, двигаясь по орбите с ускорением электрон должен непрерывно излучать энергию, а значит он будет двигаться по спирали и рано или поздно упадет на ядро. К этому времени была доказана дискретность электрической энергии. Поэтому Бор выдвинул гипотезу – двигаясь по орбите электрон не излучает и не поглощает энергии, это происходит только при переходе электрона с одной орбиты на другую. Причем чем меньше радиус орбиты, тем меньше энергия электрона. Значит, переходя на более удаленную орбиту электрон должен поглощать энергию, а переходя на меньшую орбиту электрон излучает энергию.
Современная теория строения атома (ТСА) возникла как результат переосмысления и дополнения теорий Резерфорда и Бора. Самым важным понятием ТСА стало понятие об электронном облаке, которое пришло на смену понятию об электроне как частице, которая двигается по определенной траектории. Современная ТСА учитывает волновые свойства электрона.
У электрона двойственная природа. Как частица он имеет определенную массу (хотя и очень маленькую даже по сравнению с протоном) и заряд, а как волна – он имеет способность огибать препятствие (дифракция). Для электрона нельзя одновременно точно измерить координаты и энергию. Он двигается с очень большой скоростью и характер движения у него – вероятностный. Т.е. он двигается не по определенной траектории, а хаотично, в пространстве около ядра, причем вероятность пребывания его в разных точках этого пространства неодинакова. Это пространство около ядра, где пребывание электрона наиболее вероятно называют электронным облаком или электронной орбиталью.
Орбитали имеют определенные размеры, форму и располагаются в пространстве определенным образом. Для характеристики этих свойств орбиталей используют квантовые числа. Их всего 4.
Главное квантовое число определяет размеры орбитали, а значит и степень удаленности от ядра. Именно от главного числа (размера орбитали) больше всего зависит энергия электрона. Орбитали приблизительно одного размера образуют электронный слой (электронный уровень). Число может иметь значения n = 1,2,3,4… и чем больше значение n, тем больше, обычно, энергия электрона. Часто строение атома изображают в виде схемы:
 т.е. для натрия (№11) +11)2)8)1
т.е. для натрия (№11) +11)2)8)1
Форму электронного облака определяет второе (орбитальное, побочное) квантовое число. Орбитальное квантовое число принимает значения от 0 до n -1. Если не проводят вычисления, то для удобства форму орбиталь обозначают не цифрами, а буквами: s, p, d, f… Орбитали, одинаковые не только по размеру, но и по форме образуют подуровни. Т.е. уровни делят на подуровни, орбитали одного размера могут быть разными по форме. Причем число возможных подуровней на данном уровне равно номеру этого уровня. Т.е. на 1 уровне -1 подуровень, на 2 – 2, на 3 -3 и т.д. Орбитали можно обозначать двумя символами: цифрой и буквой. Цифра говорит о размере орбитали (на каком уровне находится орбиталь), а буква говорит о форме орбитали.

 1 уровень – 1s
1 уровень – 1s
2 уровень – 2s, 2p
 3 уровень – 3s,3p, 3d
3 уровень – 3s,3p, 3d
 4 уровень – 4s, 4p, 4d, 4f…
4 уровень – 4s, 4p, 4d, 4f…
Третье квантовое число называют магнитным, оно определяет ориентацию орбитали в пространстве и число орбиталей на подуровне. Для s -подуровня число таких орбиталей на любом уровне равно 1. Для р-подуровня – 3. Для d -5. Для f – 7… Орбиталь можно изображать рисунком, а можно квантовой ячейкой – клеточкой в которой стрелками изображены электроны. Около квантовой ячейки принято главное и побочное квантовое число – размер и форму этой орбитали.
Четвертое орбитальное число характеризует состояние электрона в атоме, которое, упрощенно, можно представить, как момент собственного вращения электрона. Это число может иметь только два значения, т.е. (упрощенно) вращение возможно либо в одну сторону, либо в другую. Такую характеристику состояния электрона называют спином, а четвертое число – спиновым. В одной квантовой ячейке можно нарисовать не более двух стрелочек – электронов, с противоположными спинами. Потому что, если электроны находятся на одной орбитали (в одной квантовой ячейке), значит у них уже три одинаковых квантовых числа, и они должны отличаться хотя бы спином. Четыре квантовых числа полностью описывают состояние электрона в атоме. Если все числа одинаковые – речь идет об одном и том же электроне. Мы сформулировали первый принцип квантовой механики.
1). Принцип запрещения Паули: в атоме не может быть двух одинаковых электронов, т. е. электронов с одинаковым набором 4-х квантовых чисел. Значит на одной орбитали может быть не более двух электронов, причем, с противоположными спинами. И в одной клеточке (квантовой ячейке) мы рисуем или ↓↑, или только ↓, или только↑. Или она вообще пустая – вакантная орбиталь. Но ↑↑ - запрещено принципом Паули.
Итак, электроны размещаются на разных расстояниях от ядра, т.к. имеют разную энергию. Электронные слои образуются орбиталями, близкими по энергии. Они имеют одинаковое главное квантовое число. Эти слои часто называют электронными уровнями. Число электронных уровней у химического элемента совпадает с номером периода, в котором находится этот элемент. На каждом уровне существует определенное число подуровней (см. выше). На каждом подуровне – определенное число орбиталей. И набор возможных электронных орбиталей у всех химических элементов абсолютно одинаков! Просто у разных элементов – разное число электронов. И это число равно порядковому номеру элемента.
Но в каком порядке распределяются электроны по этим ячейкам-орбиталям? На этот вопрос отвечает второй принцип квантовой механики – принцип Клечковского.
 2). Правило Клечковского или принцип минимума энергии: т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, а если сумма одинакова, то величиной главного квантового числа. Значит подуровни по возрастанию энергии образуют ряд:
2). Правило Клечковского или принцип минимума энергии: т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, а если сумма одинакова, то величиной главного квантового числа. Значит подуровни по возрастанию энергии образуют ряд:
Верхним индексом указывают число электронов на данном подуровне. Распределение электронов в атоме по уровням и подуровням называют электронной конфигурацией атома или электронной формулой элемента.
И еще один принцип квантовой механики нам придется запомнить, чтобы правильно распределить электроны по квантовым ячейкам (графическая формула элемента).
 3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.
3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.
 К середине 19 века было известно более 60 химических элементов, но были большие трудности с их классификацией. Много попыток в этом направлении было сделано, но самого большого успеха достиг Д.И. Менделеев. Проанализировав все известные на тот момент данные об элементах, Менделеев сделал вывод, что «Все свойства химических элементов и их соединений находятся в периодической зависимости от их атомных масс». Эту фразу можно считать формулировкой Периодического закона (ПЗ). Графическим выражением ПЗ стала Периодическая система (ПС). Менделеев открыл ПЗ, когда о сложном строении атома ученые не имели не малейшего представления. Это была гениальная догадка, и она по праву считается величайшим научным открытием. Только в 20-е годы 20 века стало ясно, что элементы размещены в таблице не по возрастанию их атомной массы, а по увеличению заряда ядра элементов (протонного числа), и закономерности в изменении их свойств связаны с изменением электронной конфигурации атомов.
К середине 19 века было известно более 60 химических элементов, но были большие трудности с их классификацией. Много попыток в этом направлении было сделано, но самого большого успеха достиг Д.И. Менделеев. Проанализировав все известные на тот момент данные об элементах, Менделеев сделал вывод, что «Все свойства химических элементов и их соединений находятся в периодической зависимости от их атомных масс». Эту фразу можно считать формулировкой Периодического закона (ПЗ). Графическим выражением ПЗ стала Периодическая система (ПС). Менделеев открыл ПЗ, когда о сложном строении атома ученые не имели не малейшего представления. Это была гениальная догадка, и она по праву считается величайшим научным открытием. Только в 20-е годы 20 века стало ясно, что элементы размещены в таблице не по возрастанию их атомной массы, а по увеличению заряда ядра элементов (протонного числа), и закономерности в изменении их свойств связаны с изменением электронной конфигурации атомов.
 Сравните тот набор электронных орбиталей, который мы получили и Периодическую систему. Почему в первом периоде только 2 элемента? Почему во втором и третьем – по 8? А в четвертом – ровно 18? Почему существует именно восемь главных групп элементов? Почему элементы в одной группе похожи по свойствам? Свойства элементов и их соединений определяются их электронной конфигурацией. С возрастанием порядкового номера (числа электронов!) конфигурация повторяется – и свойства тоже повторяются.
Сравните тот набор электронных орбиталей, который мы получили и Периодическую систему. Почему в первом периоде только 2 элемента? Почему во втором и третьем – по 8? А в четвертом – ровно 18? Почему существует именно восемь главных групп элементов? Почему элементы в одной группе похожи по свойствам? Свойства элементов и их соединений определяются их электронной конфигурацией. С возрастанием порядкового номера (числа электронов!) конфигурация повторяется – и свойства тоже повторяются.
Рассмотрим, как зависят от электронной конфигурации свойства элементов.
Первое понятие, от которого будем отталкиваться – понятие «завершенного электронного слоя». Слой считается завершенным если следующий электрон попадает на более высокий уровень. Завершенный слой - энергетически наиболее выгодная электронная конфигурация. Для всех слоев кроме первого это - s2p6 (для 1 слоя - просто s2). (Выгодными энергетически являются также заполненные подуровни и наполовину заполненные подуровни). Поэтому все элементы стремятся иметь конфигурацию s2p6, но имеют ее только последние элементы в периодах. Они имеют настолько выгодное расположение электронов по орбиталям, что не хотят его менять и поэтому не вступают в химические реакции. Эти элементы называют инертными газами.
Все остальные элементы хотят иметь завершенный внешний электронный слой, но … увы. Чтобы завершить слой элементы либо отдают свои валентные электроны, либо присоединяют электроны, забирая у других атомов. Валентными называют электроны, которые атомы могут отдать в химических реакциях, которые принимают участие в образовании связей между атомами. К валентным электронам относятся электроны незавершенного внешнего электронного слоя и электроны d-подуровня предпоследнего слоя, если этот подуровень не завершён.
По способу получения завершенного электронного слоя все химические элементы делят на металлы и неметаллы. Металлы всегда завершают свой слой отдавая электроны, неметаллы способны забрать чужие электроны. От чего зависит эта способность – отдавать или забирать электроны? От электронной конфигурации элемента, от расположения электронов на уровнях, подуровнях и орбиталях.
Количество энергии, необходимой для отрыва от атома одного электрона называется энергией ионизации. Эта энергия зависит того, насколько прочно электрон связан с ядром атома. А сила взаимодействия между ядром атома и электронами внешнего слоя зависит от числа электронов на этом слое (величина заряда оболочки) и размера электронной оболочки (номера уровня, радиуса атома). Вспомните закон Кулона. Чем больше заряды и меньше расстояние, тем сильнее взаимодействие между заряженными частицами.
Наименьшей энергией ионизации обладают щелочные металлы (1-А группа), которые имеют один электрон на внешнем слое. Эти металлы легко теряют этот электрон и поэтому являются типичными металлами. У элементов в периоде увеличивается число электронов на внешнем слое, значит растет величина заряда. А радиус немного уменьшается, электроны все больше притягиваются к ядру. И то и другое способствует увеличению энергии ионизации, а значит в периоде металлические свойства уменьшаются.
В группах у элементов конфигурации похожи, у них одинаковое число электронов на соответствующих подуровнях. Но у них разное число слоев, с увеличением числа слоев радиус атомов увеличивается и электроны слабее удерживаются ядром, а значит легче отрываются. Чем больше радиус атома, тем энергия ионизации становится меньше, металлические свойства увеличиваются.
 Типичные металлы – это s-элементы, у которых на внешнем слое 1-2 электрона. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». Эти металлы обычно достаточно легко отдают электроны внешнего слоя, т.е. ведут себя как обычные металлы. Но при взаимодействии с некоторыми элементами они могут потерять часть или даже все электроны частично заполненного предпоследнего d-подуровня. Т.е. валентными являются не только электроны внешнего слоя, но и незаполненного подуровня. У р-элементов на внешнем слое больше электронов, чем у s – элементов, а значит сила взаимодействия электронной оболочки с ядром тоже больше, энергия ионизации увеличивается. Поэтому металлические свойства для них не характерны. Но у р-элементов становиться возможным завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО). Элементы с низкой ЭО – это металлы, они чужие электроны практически не притягивают. Элементы с высокой ЭО относятся к неметаллам. Чем больше ЭО, тем сильнее неметаллические свойства. В периодах ЭО увеличивается с увеличением порядкового номера потому что растет число электронов на внешнем слое. В группах ЭО уменьшается сверху вниз, т.е. с увеличение числа электронных слоев (увеличением радиуса атомов). Поллингу удалось измерить эту характеристику атомов, и он расположил элементы в ряд в порядке уменьшения ЭО:
Типичные металлы – это s-элементы, у которых на внешнем слое 1-2 электрона. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». Эти металлы обычно достаточно легко отдают электроны внешнего слоя, т.е. ведут себя как обычные металлы. Но при взаимодействии с некоторыми элементами они могут потерять часть или даже все электроны частично заполненного предпоследнего d-подуровня. Т.е. валентными являются не только электроны внешнего слоя, но и незаполненного подуровня. У р-элементов на внешнем слое больше электронов, чем у s – элементов, а значит сила взаимодействия электронной оболочки с ядром тоже больше, энергия ионизации увеличивается. Поэтому металлические свойства для них не характерны. Но у р-элементов становиться возможным завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО). Элементы с низкой ЭО – это металлы, они чужие электроны практически не притягивают. Элементы с высокой ЭО относятся к неметаллам. Чем больше ЭО, тем сильнее неметаллические свойства. В периодах ЭО увеличивается с увеличением порядкового номера потому что растет число электронов на внешнем слое. В группах ЭО уменьшается сверху вниз, т.е. с увеличение числа электронных слоев (увеличением радиуса атомов). Поллингу удалось измерить эту характеристику атомов, и он расположил элементы в ряд в порядке уменьшения ЭО:

Т.е. наиболее ярко неметаллические свойства проявляет фтор, у него максимальная ЭО и он никому не отдает свои электроны, зато заберет их практически у любого атома.
Важной характеристикой химического элемента является степень окисления. Степень окисления - это условный заряд, который мог бы появиться на атоме, если бы он принял чужие или отдал свои электроны. У атома число протонов, равно числу электронов, заряда нет, степень окисления равна нулю. Когда атом теряет свои электроны, стремясь получить завершенный электронный слой у него может появляется положительный заряд, говорят, что атом получает положительную степень окисления. Если такая частица реально существует, ее назовут положительным ионом (катионом). Для металлов возможны только положительные степени окисления. Причем для s – элементов только одна постоянная (или 1 или 2). У p - и d – элементов больше валентных электронов, и не всегда атом отдает все электроны. Но посчитать максимальную степень окисления, т.е. максимальное количество электронов, которые атом может отдать – всегда можно по ПС. Для элементов главных групп эта степень окисления равна номеру группы, т.е. числу электронов на внешнем слое. Отрицательная степень окисления может быть только у неметаллов. Она характеризует заряд, который бы появился на атоме, если тот примет электроны, чтобы завершить свой электронный слой. Отрицательная степень окисления у элемента может быть только одна. Для элементов с самой большой ЭО (фтора и кислорода) отрицательная степень окисления является практически единственно возможной.
Зная возможные степени окисления элементов можно составить формулы бинарных соединений. А по формуле вещества можно вычислить степень окисления элемента в нем.
Степень окисления элементов в простом веществе равна нулю. Примеры: Na0, H02, P04.
Сумма степеней окисления всех атомов в сложном веществе равна нулю.
Алгоритм вычисления степени окисления:
1) Обозначить известные с.о.
2) Обозначить за «Х» неизвестную с.о.
3) Составить уравнение, пользуясь правилом «Сумма степеней окисления всех атомов в сложном веществе равна нулю, а в ионе – заряду иона».
4) Решить уравнение
Рассмотрим применение этого правила на простых примерах.
Пример 1. Необходимо найти степени окисления элементов в FeCl3
Решение. 1) Обозначим известную с. о. Сl, она равна -1.
2) Неизвестную степень окисления железа обозначаем «х».
3) Составляем простейшее уравнение: х + 3∙(-1) = 0.
Решение очевидно: х = 3. Ответ: Fe+3Cl-3.
Еще одним важным свойством элемента, которое зависит от электронного строения атома является валентность. Забегая вперед, можно сказать. Что большинство связей между атомами образуется за счет неспаренных электронов. Неспаренные электроны имеют избыточную, по сравнению со спаренными электронами энергию и поэтому активно «ищут себе пару». Можно сказать, число неспаренных электронов в атоме определяет число связей (валентность), которую этот атом может проявлять. Число неспаренных электронов можно посчитать, если записать распределение электронов по квантовым ячейкам. Нужно только помнить, что кроме стационарного состояния атома (по правилу Клечковского) у атома может существовать и возбужденное состояние. И даже несколько. А значит и валентность тоже может быть постоянной и переменной.
Зная степень окисления и валентность элемента, его ЭО, мы можем составить формулы соединений элемента (оксиды, гидроксиды, водородные соединения) и предсказать их свойства.
Итак, свойства химических элементов зависят от строения их электронных оболочек. Это строение (электронная конфигурация) закономерно изменяется и повторяется через определенное число элементов. Элементы имеющие похожее строение образуют «естественные семейства химических элементов», очень похожих по своим свойствам друг на друга. Они входят в одну подгруппу ПС.
Современная формулировка ПЗ читается так: «Свойства химических элементов и их соединений изменяются периодически с возрастанием заряда ядра атомов химических элементов, потому что периодически изменяется электронная конфигурация атомов этих элементов». Зная положение элемента в ПС, мы может характеризовать его электронное строение и свойства.
Характеристика элемента по ПС (план)
1) положение в ПС (порядковый номер, период, группа, подгруппа, атомная масса)
2) состав атома (число протонов, нейтронов, электронов)
3) распределение электронов по уровням, подуровням, орбиталям (схема строения, электронная формула, квантовые ячейки).
4) характеристика электронного строения и свойств элемента и его соединений (число электронных слоев, завершен ли внешний электронный слой, сколько на нем электронов, какова ЭО элемента, характерные степени окисления; число неспаренных электронов, свободных орбиталей, возможная валентность элемента, состав и свойства высшего оксида и гидроксида, ЛВС данного элемента);
5) металлические или неметаллические свойства преобладают у элемента, и сравнение свойств этого элемента с соседями по периоду и подгруппе.
Например:
1) фосфор (Р) находится в 3 периоде, 5А группа, №15, Аr = 31.
2) в атоме 15р, 15е, 16n
 3) 4) в атоме три электронных слоя, внешний слой не завершен, нем 5 электронов на внешнем слое, 3 из них- неспаренные, есть свободные 3d орбитали, поэтому в возбужденном состоянии в атоме будут 5 неспаренных электронов;
3) 4) в атоме три электронных слоя, внешний слой не завершен, нем 5 электронов на внешнем слое, 3 из них- неспаренные, есть свободные 3d орбитали, поэтому в возбужденном состоянии в атоме будут 5 неспаренных электронов;
электроотрицательность не очень высокая, максимальная степень окисления +5, минимальная -3, причем более устойчива +5; возможны валентности III и V, причем последняя более характерна; формула высшего оксида Р2О5, ему соответствует гидроксид Н3РО4 они имеют кислотные свойства, ЛВС имеет формулу РН3
5) фосфор - неметалл, но эти свойства у него проявляются не очень сильно, у его соседей по периоду неметаллические свойства сильнее проявляются у серы, а у кремния – меньше; у его соседей по группе неметаллические свойства сильнее проявляются у азота, а у мышьяка – меньше.
.