Регуляция каталитической активности ферментов
Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
- аллостерическая регуляция;
- регуляция с помощью белок-белковых взаимодействий;
- регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
- регуляция частичным (ограниченным) протеолизом.
Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
· Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
· при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
· при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
· для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
· для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
· Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором.
· Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах.
· Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
· Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Особенности строения и функционирования аллостерических ферментов:
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
· аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
· протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;
· аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента (рис. 2-30);
· регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
· аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
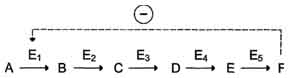
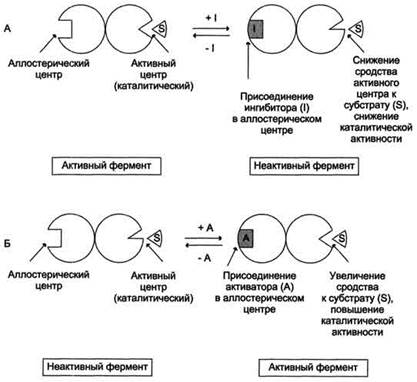
Рис. 2-30. Схема, поясняющая работу аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора (активатора).
· Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
· В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:

· В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы (рис. 2-31). Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
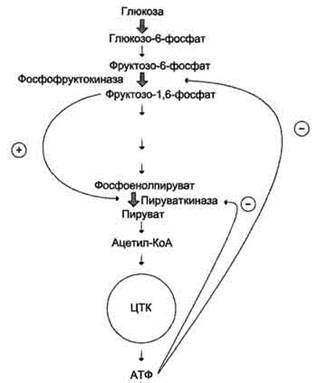
Рис. 2-31. Схема положительной и отрицательной регуляции катаболизма глюкозы. Молекула АТФ участвует в ретроингибировании аллостерических ферментов фосфофруктокиназы и пируваткиназы. Фруктозе-1,6-бисфосфат - активатор метаболического пути распада глюкозы. Плюсами отмечена активация, минусами - ингибирование ферментов.
Благодаря такой регуляции осуществляется слаженность протекания метаболического пути распада глюкозы.