в организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). О.-в. р. катализируются ферментами оксидоредуктазами. Энергия, выделяющаяся при некоторых О.-в. р., запасается в химических связях молекул аденозинтрифосфорной кислоты (АТФ) и др. макроэргических соединений. К О.-в. р. относятся реакции трикарбоновых кислот цикла, реакции переноса электронов при дыхании, фотосинтезе, брожении и гликолизе, реакции окисления и синтеза жирных кислот и многие др. процессы, протекающие в любой живой клетке. См. Окисление биологическое.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электростатического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
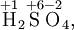
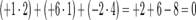
Степень окисления в ряде случаев не совпадает ни с валентностью (например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях CH4, CH3OH, HCOOH соответственно равно −4, −2 и +2), ни с фактическим числом электронов, которые участвуют в образовании связей.
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Важнейшие восстановители и окислители
Восстановители
Окислители
Металлы,
водород,
уголь.
Окись углерода (II) (CO).
Сероводород (H2S);
оксид серы (IV) (SO2);
сернистая кислота H2SO3 и ее соли.
Галогеноводородные кислоты и их соли.
Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3.
Азотистая кислота HNO2;
аммиак NH3;
гидразин NH2NH2;
оксид азота(II) (NO).
Катод при электролизе.
Галогены.
Перманганат калия(KMnO4);
манганат калия (K2MnO4);
оксид марганца (IV) (MnO2).
Дихромат калия (K2Cr2O7);
хромат калия (K2CrO4).
Азотная кислота (HNO3).
Серная кислота (H2SO4) конц.
Оксид меди(II) (CuO);
оксид свинца(IV) (PbO2);
оксид серебра (Ag2O);
пероксид водорода (H2O2).
Хлорид железа(III) (FeCl3).
Бертоллетова соль (KClO3).
Анод при электролизе.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
26. Разбавленная серная кислота ведет себя, как обычная кислота.
Активные металлы, стоящие в ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты.
Мы видим пузырьки газа в пробирке с цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь.
Как поведут себя цинк и медь в концентрированной серной кислоте?
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
2H2SO4 + Zn = SO2 ↑+ZnSO4 + 2H2O
Медь - менее активный металл. При взаимодействии с конц серной кислотой восстанавливает ее до сернистого газа.
2H2SO4 конц. + Cu = SO2 ↑+ CuSO4 + 2H2O
Значит, в двух пробирках мы наблюдаем выделение сернистого газа.
Взаимодействие металлов со щелочами
Cо щелочами взаимодействуют амфотерные металлы Zn, Be, Al, Sn, Pb и
др. Реакция протекает сплавлением металлов со щелочью или при
взаимодействии с крепким раствором щелочи:
Pb + 2NaOH = Na2PbO2 + H2
Pb0 - 2ē = Pb+2
2H+ + 2ē = H20
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Be0 - 2ē = Be+2
2H2O + 2ē = H20 + 2OH-
Взаимодействие металлов с кислотами
Разбавленные кислоты. Соляная и разбавленная серная кислоты
реагируют с металлами, стоящими в ряду напряжений до водорода. При этом
образуется соответствующая соль и выделяется водород:
Co + H2SO4 = CoSO4 + H2
Co0 - 2ē = Co2+
2H+ + 2ē = H20
Разбавленная азотная кислота окисляет практически все металлы, при этом
образуются нитрат соответствующего металла, вода и продукт восстановления
N+5(NO – бесцветный газ с резким запахом, N2O – газ с наркотическим запахом,
N2 –газ без запаха, NH4NO3 – бесцветный раствор). Чем более активным
является металл, тем сильнее восстанавливается азот в азотной кислоте:
3Co + 8HNO3 = 3Co(NO3)2 + 2NO + 4H2O
Co0 - 2ē = Co2+ 3
- +
NO3 + 4H + 3ē = NO + 2H2O 2
5Mn + 12HNO3 = 5Mn(NO3)2 + N2 + 6H2O
Mn0 - 2ē = Mn+2 5
2NO3- + 12H+ + 10ē = N2 + 6H2O 1
Все щелочные металлы реагируют с водой, восстанавливая ее до водорода. Активность взаимодействия металлов с водой увеличивается от лития к цезию.
27. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
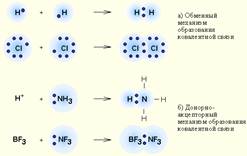
Рисунок 3.2.
Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи.
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Модель 3.1. Виды химической связи.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
 Рисунок 3.3.
Рисунок 3.3.
Образование внутримолекулярной водородной связи.
 Рисунок 3.4.
Рисунок 3.4.
Образование межмолекулярной водородной связи.
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 311 °C. В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Аммиак NH3. Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
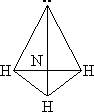
Строение молекулы. Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.