Урок 72 Лекция
Цель: рассмотреть строение атомовэлементов IV группы главной подгруппы углерода и кремния; взаимосвязь строения атомов с их химическими свойствами.
Элементы IV группы – это углерод, кремний, германий, олово и свинец. Более подробно рассмотрим свойства углерода и кремния. В таблице приведены важнейшие характеристики этих элементов.
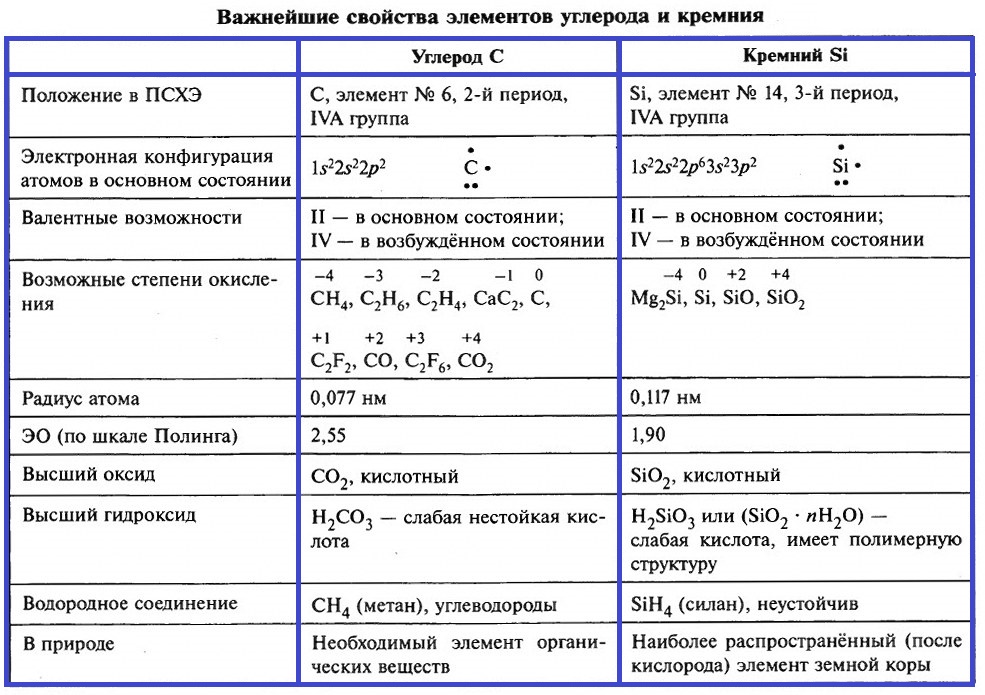
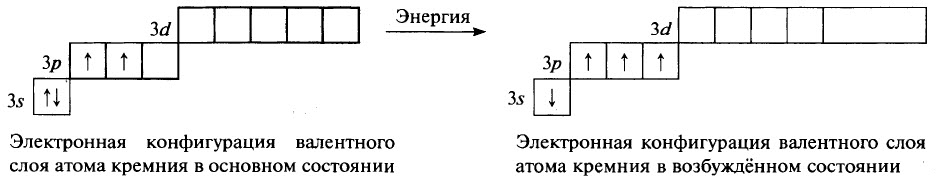
Почти во всех своих соединениях, углерод и кремний четырёхвалентны, их атомы находятся в возбуждённом состоянии. Конфигурация валентного слоя атома углерода при возбуждении атома меняется: 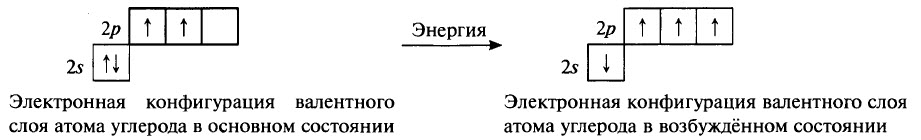
На внешнем энергетическом уровне атомов углерода и кремния находится 4 неспаренных электрона. Радиус атома кремния больше, на его валентном слое имеются вакантные 3d –орбитали, это обусловливает отличия в характере связей, которые образуют атомы кремния.
Степени окисления углерода меняются в интервале от –4 до +4.
С−4Н4 + 2О2 = С +4О2 + 2Н2О
Характерной особенностью углерода является его способность образовывать цепи: атомы углерода соединяются друг с другом и образуют устойчивые соединения. Аналогичные соединения кремния неустойчивы. Способность углерода к цепеобразованию обусловливает существование огромного числа органических соединений.
К неорганическим соединениям углерода относятся его оксиды, угольная кислота, карбонаты и гидрокарбонаты, карбиды. Остальные соединения углерода являются органическими.
Для углерода характерна аллотропия, его аллотропными модификациями являются алмаз, графит, карбин, фуллерен. Сейчас известны и другие аллотропные модификации углерода.
Уголь и сажу можно рассматривать как аморфные разновидности графита.
Кремний образует простое вещество – кристаллический кремний. Существует аморфный кремний – порошок белого цвета (без примесей). Свойства алмаза, графита и кристаллического кремния приведены в таблице. 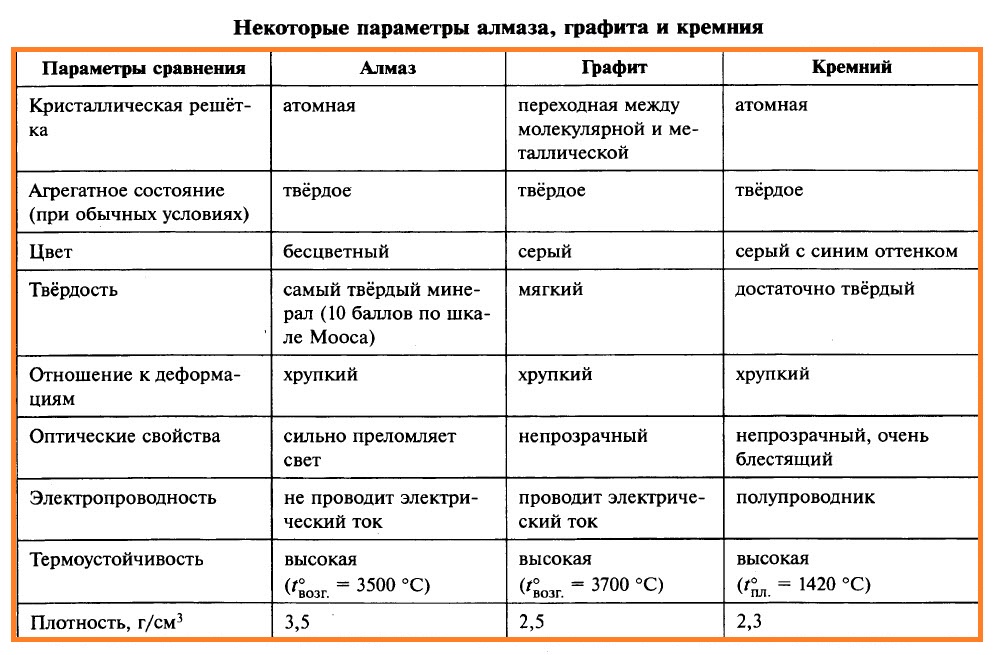
|
|
Причина явных отличий в физических свойствах графита и алмаза обусловлена различным строением кристаллической решётки. В кристалле алмаза каждый атом углерода (исключая те, которые находятся на поверхности кристалла) образует четыре равноценные прочные связи с соседними атомами углерода. Эти связи направлены к вершинам тетраэдра (как в молекуле СН4). Таким образом, в кристалле алмаза каждый атом углерода окружён четырьмя такими же атомами, располагающимися в вершинах тетраэдра. Симметричность и прочность С–С-связей в кристалле алмаза обусловливают исключительную прочность и отсутствие электронной проводимости.
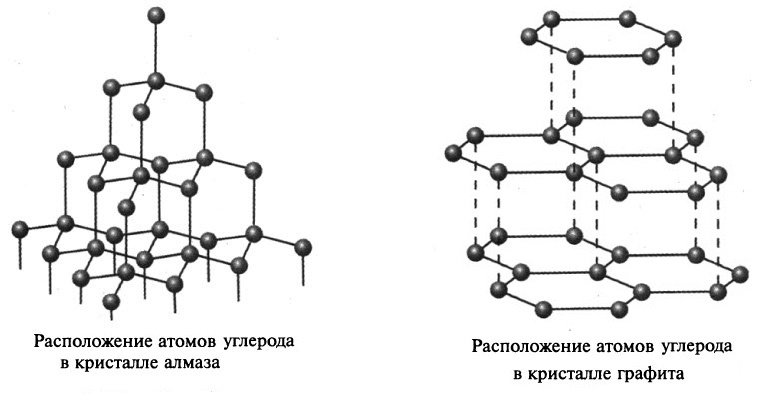
В кристалле графита каждый атом углерода образует три прочные равноценные связи с соседними атомами углерода в одной плоскости под углом 120°. В этой плоскости образуется слой, состоящий из плоских шестичленных колец.
Длина связи С–С внутри слоя составляет 0,142 нм, расстояние между слоями – 0,335 нм. В результате связи между слоями гораздо менее прочны, чем связи между атомами внутри слоя. Это обусловливает свойства графита: он мягок, легко расслаивается, имеет серый цвет и металлический блеск, электропроводен и химически более активен, чем алмаз.
Можно графит превратить графит в алмаз. Такой процесс осуществим в жёстких условиях – при давлении примерно 5000 МПа и при температуре от 1500 °С до 3000 °С в течение нескольких часов в присутствии катализаторов (Ni). Основную массу продукции составляют небольшие кристаллы (от 1 до нескольких мм) и алмазная пыль.
|
|
Карбин – аллотропная модификация углерода, в которой атомы углерода образуют линейные цепи типа: –С≡С–С≡С–С≡С– или =С=С=С=С=С=С=.
Карбин представляет собой чёрный порошок, является полупроводником. Химически он более активен, чем графит.
Фуллерен – аллотропная модификация углерода, образованная молекулами С60, С70 или С84. Все фуллерены представляют собой замкнутые структуры из атомов углерода. Кристаллы фуллерена относятся к веществам с молекулярным строением.
Кремний. Существует только одна устойчивая аллотропная модификация кремния, кристаллическая решётка которой подобна решётке алмаза. Кремний – твёрдое, тугоплавкое (t °пл = 1412 °С), очень хрупкое вещество тёмно-серого цвета с металлическим блеском, при стандартных условиях – полупроводник.
Химические свойства углерода
Реакционная способность углерода зависит от аллотропной модификации. Углерод в виде алмаза и графита довольно инертен, устойчив к действию кислот, щелочей, что позволяет изготавливать из графита тигли, электроды и т. д. Более высокую реакционную способность углерод проявляет в виде угля и сажи.
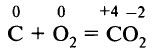 Для угля характерна окислительно-восстановительная двойственность. По отношению к большинству неметаллов уголь выступает в роли восстановителя. При нагревании (600–700 °С) уголь сгорает в кислороде или на воздухе:
Для угля характерна окислительно-восстановительная двойственность. По отношению к большинству неметаллов уголь выступает в роли восстановителя. При нагревании (600–700 °С) уголь сгорает в кислороде или на воздухе:
При температуре выше 1000 °С образуется преимущественно оксид углерода (II) СО.
Углерод реагирует со фтором, но ни уголь, ни углерод в любой другой аллотропной модификации непосредственно не реагирует с другими галогенами.
|
|
При температуре примерно 700–800 °С уголь взаимодействует с серой с образованием сероуглерода. Уголь является хорошим восстановителем и по отношению ко многим сложным веществам. С помощью угля можно восстанавливать некоторые металлы из их оксидов при нагревании (карботермия):
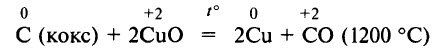
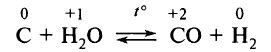
Уголь взаимодействует с водяным паром при t ° 800–1000 °С (реакция обратима):
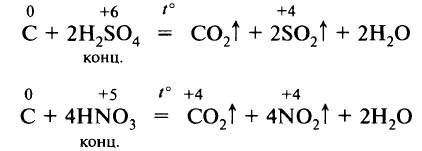 При нагревании уголь взаимодействует с концентрированными серной и азотной кислотами:
При нагревании уголь взаимодействует с концентрированными серной и азотной кислотами:
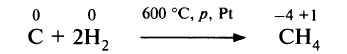
Уголь может также выступать и в роли окислителя, обычно по отношению к металлам и водороду. Уголь взаимодействует с водородом при высоких давлениях (примерно 10 МПа), повышенной температуре и при наличии катализатора. Образуются метан и другие углеводороды:
При температуре 1200–1300 °С графит взаимодействует с кремнием, образуя карборунд:
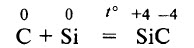
 При высоких температурах уголь (графит) взаимодействует с металлами, образуя карбиды:
При высоких температурах уголь (графит) взаимодействует с металлами, образуя карбиды: