Neonatology A Practical Approach to Neonatal Diseases 2016
Giuseppe Buonocore, Rodolfo Bracci, Michael Weindling
Перевод: Баскевич М.А. врач анестезиолог-реаниматолог
Синдром мекониальной аспирации
Аббревиатуры
ECMO Экстракорпоральная мембранная оксигенаци
HFOV Высокочастотная осцилляторная вентиляция
iNO Ингаляционный оксид азота
MAS с-м мекониальной аспирации
MSAF окрашенные меконием околоплодные воды
Аннотация
Синдром аспирации мекония - это болезнь, характеризующаяся дыхательной недостаточностью различной степени тяжести, при которой повреждение легких начинается пренатально. Роль мекония в патогенезе заболевания еще не до конца известна, хотя имеется все больше свидетельств, что хронический внутриутробный дистресс может быть ответственен за запуск повреждения легких, а также способствует попаданию мекония в амниотическую жидкость. Уровень выживания значительно улучшился за последние три десятилетия благодаря новым и более эффективным методам лечения. С другой стороны, существует обеспокоенность по поводу долгосрочных неврологических и легочных исходов у выживших.
Введение
Термин меконий происходит от греческого слова «mekoni», что означает сок мака или опий из-за его смолистого вида или из-за мнения Аристотеля в то, что он вызывает сон у плода. Меконий представляет собой первый стул новорожденного ребенка. Пассаж мекония обычно происходит в течение 48 ч. после рождения; Однако это может произойти в утробе матери.
Оптимальная помощь ребенку, рожденному с околоплодными водами, окрашенными меконием (MSAF), должна осуществляться акушером и педиатром вместе. Действительно, лечение ребенка с риском развития синдрома мекониальной аспирации (MAS) начинается в родильном отделении или даже раньше во время внутриутробного периода жизни. MAS определяется как респираторный дистресс у новорожденного, с MSAF, чьи симптомы не могут быть объясненным иначе; примерно 13% живорожденных младенцев рождаются с MSAF, в то время как МАS встречается только у 2–6% этих новорожденных (Cleary and Wiswell 1998). Ретроспективный обзор исходов и схем лечения у доношенных новорожденных поступивших в реанимационное отделение в течение 10-летнего периода указывает на растущую вероятность МАS по мере увеличения гестационного возраста (от 1,1% на 37 неделе беременности до 24% на > 42 недели беременности), довольно постоянную смертность на уровне около 1,2%, несмотря на изменения в интенсивной терапии в последнее десятилетие, и более высокий риск смертности для новорожденных со ЗВУР, родившихся путем операции кесарева сечения, с низкой оценкой по шкале Апгар, с легочной гипертензией и при использовании цефотаксима (Singh и другие. 2009).
Впервые отмечено, что меконий появляется в 12 недель беременности у плода человека. Это побочный продукт от заглоченных околоплодных вод плода, лануго, клеток кожи и казеозных клеток; т.о.он содержит клетки, полученные через желудочно-кишечный тракт. В состав мекония также входят четыре разные желчные кислоты (желчная, хенодезоксихолевая, дезоксихолевая и литохолевая) и минералы, такие как медь, цинк, магний, кальций железо и фосфор, которые являются наиболее распространенными. К тому же, он содержит плазматические белки, такие как α1-антитрипсин и фосфолипаза А2, свободные жирные кислоты, билирубин и ферменты. Пассаж меконий из организма плода в амнион на ранних сроках беременности предотвращается отсутствием перистальтики кишечника из-за низкого уровня мотилина, тоническим сокращением анального сфинктера и формированием терминальной пробки из вязкого мекония. MSAF при поздних сроках беременности может быть естественным явлением, которое отражает состояние переношенного плода со зрелым желудочно-кишечным трактом, в котором уровень мотилина вырос. С другой стороны, MSAF, как правило, связан с определенными перинатальными условиями (такими как задержка внутриутробного развития, преэклампсия, эклампсия, сахарный диабет у матери), которые могут нарушать маточно-плацентарное кровообращение, с развитием острой или хронической гипоксии плода и ацидоза, при наличии или отсутствии дистресса плода, происходит расслабление анального сфинктера, которое более легко происходит у доношенных, чем у недоношенных новорожденных, благодаря «созревшей инервации».
Патогенез
Традиционное убеждение состояло в том, что аспирация мекония происходит сразу после рождения. Несколько исследователей предположили, однако, что большинство случаев аспирации мекония происходят в утробе матери, когда у плода появляются вдохи по типу гаспинг перед рождением. Таким образом, сейчас считается, что МАS иногда будет происходить, несмотря на соответствующую защиту дыхательных путей при родах. В настоящее время нет никакого способа различить новорожденного, у которого развилась МАS в следствие внутриутробного запуска дыхания и новорожденного, у которого произошла MAS при вдыхании мекония при первых вдохах после родов.
Но действительно ли МАS вызван прямым повреждением меконием легких? Непонятно, почему у некоторых детей, рожденных с MSAF, развивается аспирационный синдром в то время как у других нет. Известно, что присутствие мекония под голосовыми связками связано с более высоким риском MAS, но его отсутствие не означает, что у ребенка не разовьются тяжелые дыхательные нарушения. По мнению Ghidini and Spong, нет корреляции между присутствием мекония в трахее и клиническими симптомами, так у 2/3 детей с наличием мекония в трахее не развиваются никакие дыхательные нарушения и у половины из тех, у кого будет респираторный дистресс не будет мекония в легких (Ghidini and Spong 2001). Таким образом, корреляция между присутствием мекония в дыхательных путях и развитием дыхательных нарушений не является очевидной. Предполагается, что другие патологические состояния, такие как внутриутробная асфиксия (нехватка кислорода) может вызвать МАS, в то время как наличие мекония в околоплодных водах и легких являются лишь побочной находкой или следствием стрессового дистресса плода. Внутриматочная асфиксия приводит к ремоделированию легочных сосудов, проявляющееся утолщением мышечного слоя легочных сосудов и формированием аномальной сосудистая реактивности, ответственной за развитие персистирующей легочной гипертензии, приводящей с персистирующей гипоксемии, часто наблюдаемой у новорожденных с тяжелым MAS (Wiswell et al. 2000). Данные аутопсии при тяжелых МАS показали, что почти в 100% случаев присутствует мускуляризация (разрастание мышечного слоя) в дистальных легочных артериолах. De novo для мускуляризации необходимо минимум 3–8 дней, поэтому это фактически предшествует аспирации мекония (Thureen et al. 1997). Все больше данных свидетельствуют о том, что хронический внутриутробный стресс может быть ответственным за большинство случаев тяжелых МАS, а не острая гипоксия. Хроническая гипоксия плода и ацидоз могут привести к дыханию по типу гаспинг и последующей внутриутробной аспирации мекония. Это подтверждается находками на аутопсиях - меконий в альвеолах мертворожденных или младенцев, умерших вскоре после рождения без спонтанного дыхания. В отличие от этих тяжелых случаев, активный новорожденный, который аспирирует окрашенную меконием жидкость из носоглотки при рождении обычно разовьет болезнь от легкой до умеренной степени тяжести. Патогенные события, ведущие к легкой МАS и тяжелой МАS, кажется, разные, и события, предшествующие родам (такие как хроническая гипоксия или инфекция) являются преимущественно ответственными за развитие тяжелого МАS. Это важный момент, поскольку это касается
возможности предотвратить тяжелый МАS, потому что вероятно, единственно возможная профилактика может быть во время внутриутробной жизни. Несомненно, меконий в легких изменяет физиологию легких, но не ясно, насколько повреждение легких при MAS (воспаление, дисфункция сурфактанта, вазоконстрикция, гиперреактивность дыхательных путей) связано с прямой токсичностью мекония на ткань легких или, все же, частично с хронической или острой гипоксией, начинающейся до родов.
Механизмами повреждения легких при MAS являются (1) механическая обструкция дыхательных путей меконием различной степени, ведущая к зонам ателектаза с несоответствием вентиляции / перфузии и зон воздушных ловушек с высоким риском утечки воздуха; (2) пневмонит, с воспалительным ответом, характеризующимся наличием повышенного количества клеток и провоспалительных цитокинов (IL8, IL6, Il1β,TNF-α), который может отрицательно влиять на ткани и вызвать увеличение проницаемости микрососудов, приводя к геморрагическому отеку легких и экссудации белков плазмы в просвет альвеол, ведущее к (3) инактивации сурфактанта путем разбавления и прямого ингибирования, помимо повреждения альвеолярных пневмоцитов типа II; и (4) вазоконстрикции легочных сосудов, приводящей к легочной гипертензии и персистенции фетальных коммуникаций, что возникает по данным исследований in vitro не только из-за прямого вазоконстрикторного эффекта мекония, но, возможно, и из-за повышения концентраций ряда гуморальных факторов, такие как тромбоксан или TNF-α, паренхимой легкого, способных потенциировать вазоконстрикторный эффект мекония на легочные сосуды (Тесслер и другие. 2008).
Воспаление играет главную роль в патогенезе МАS и легочная функция улучшается одновременно с разрешением воспаления. Провоспалительные вещества в меконии могут вызвать воспаление легких при MAS напрямую через цитокины и гем в меконии и косвенно, индуцируя выброс цитокинов из эпителиальных клеток и альвеолярных макрофагов. IL-1b, IL-6 и IL-8, находятся на высоком уровне в раннем постнатальном периоде у детей с МАS, что с высокой вероятностью позволяет говорить о том, что уровень этих цитокинов начал повышаться внутриутробно до рождения, поддерживая гипотезу аспирации мекония в большинстве случаев МАS до рождения (Cayabyab и другие. 2007).
Профилактические стратегии
Как уже упоминалось, снижение заболеваемости МАS за последние три десятилетия, вероятно, связано с совершенствованием дородовой помощи, что привело к снижению количества переношенных беременностей и лучшему мониторингу за состоянием плода до и во время родов высокого риска, например, роды плодом с задержкой внутриутробного развития. Эффективные вмешательства для дальнейшего снижения заболеваемости МАS, вероятно, могут быть выполнены только на дородовом или перинатальном этапе в виде устранения причины острой или прежде всего хронической гипоксии плода. Дородовые, перипартальные и послеродовые вмешательства по удалению мекония из дыхательных путей новорожденного, чтобы предотвратить его аспирацию из MSAF в течение последних трех десятилетий были предложены следующие (1) амниоинфузия, (2) санация ВДП новорожденного до первого вдоха и (3) интубация трахеи с последующей санацией сразу после родов. Амниоинфузия была предложена в случаях, когда при мониторинге появляется вариабельность сердечного ритма у плода. Потенциальными механизмами амниоинфузии являются механическая амортизация пуповины, при котором данное вмешательство могло бы исправить и предотвратить повторные сдавливания пуповины, и разбавление мекония, что может уменьшить его механические и воспалительные эффекты в патогенезе MAS. Однако, оказалось, что в случаях, когда проводится электронный мониторинг состояния плода обычно амниоинфузия не дает дополнительных преимуществ в плане профилактики МАS, тогда как при отсутствии этих возможностей, часто в развивающихся странах, амниоинфузия былапротективной методикой с улучшенными неонатальными исходами, уменьшением случаев MAS (4% против 18%) и улучшением материнских исходов (Xu et al. 2007). Комитет ACOG по Акушерству недавно выпустил рекомендации, что «рутинная профилактическая амниоинфузия для разведения MSAF должна выполняться только в рамках дополнительных клинических испытаний. Однако амниоинфузия остается разумным подходом при лечении повторяющихся сердечных децелераций плода, независимо от присутствия мекония в амниотической жидкости» (Комитет ACOG Акушерская практика 2006).
Санация ВДП при рождении головки в сочетании с интубацией трахеи новорожденного после родов с MSAF, считалась стандартной процедурой на протяжении более 25 лет. Целью было очистить насколько это возможно дыхательные пути от мекония, прежде чем новорожденный сделает первый вдох. Тем не менее, самые последние международные клинические рекомендации по реанимации новорожденных предлагают санацию сразу после рождения, только если дыхательные пути кажутся заблокированными или когда при ИВЛ с положительном давлением сохраняется брадикардия. Рутинная интубации и санация для неактивного новорожденного с околоплодными водами, окрашенными меконием не рекомендуется, хотя предлагается начать респираторную поддержку в рамках базовой реанимационной помощи, как у любого другого новорожденного (Wyckoff et al. 2015). Эта позиция согласуется с недавним рандомизированным контролируемым исследованием которое продемонстрировало, что эндотрахеальная санация неактивных детей, рожденных с MSAF не снижает риск и осложнения МАS по сравнению со стратегией, при которой санацию не проводили (Chettri и другие. 2015).
Также ACOG Комитет по Акушерской Практике недавно издал следующую рекомендацию «новорожденным с MSAF больше не должны проводить санацию во время родов» (ACOG комитет по акушерской практике 2007). С другой стороны, некоторые исследователи предлагают еще более агрессивный подход: эндоскопическую внутриутробную санацию у плода перед родами (Петриковский 2004). Однако это вмешательство еще предстоит проверить и, следовательно, оно не может быть сейчас рекомендовано.
Текущие рекомендации по оказанию помощи новорожденным с околоплодными водами, окрашенными меконием в родильном зале говорят, что ИВЛ с положительным давлением должна быть начата если ребенок не дышит или у него пульс менее 100 / мин после завершения начальных шагов (Wyckoff et al. 2015). Таким образом, опытная реанимационная команда должна присутствовать на всех родах с присутствием MSAF для реанимации новорожденных по мере необходимости. Реанимация должна быть начата на воздухе (21% кислорода на уровне моря) и дополнительный кислород может назначаться в соответствии с предуктальным мониторингом насыщения крови кислородом (Wyckoff и другие. 2015).
Клиническая картина и терапия
Большинство детей, рожденных с MSAF, не требуют никаких вмешательств; Тем не менее, важно тщательно контролировать состояние этих новорожденных, т.к. признаки дыхательной недостаточности способны развиваться в течение первых 12 ч жизни.
Любой тяжелый новорожденный, родившийся с MSAF не должен априори считаться случаем MAS, пока другие причины неонатального дистресса не будут исключены. Тяжелая МАS должна перестать быть диагнозом включения (любой респираторный дистресс при MSAF с любой рентгенографической картиной), а стать диагнозом исключения. Его диагностические критерии должны быть строгими (т.е. наличие мекония во рту или трахее после родов, раннее появление дыхательной недостаточности и данные рентгенографии грудной клетки свидетельствуют о «пятнистых» областях инфильтрации или с-ме утечки воздуха) и ограниченными случаями без инфекции. Новорожденные с риском развития МАS, у которых есть признаки дыхательного дистресса (тахипноэ, цианоз, втяжение уступчивых мест грудной клетки, экспираторный стон, хрипы дистанционно и при аускультации грудной клетки, вздутая (бочкообразная) грудная клетка) должны быть переведены в отделение интенсивной терапии новорожденных. Новорожденный с тяжелым MAS потребует широкого спектра реанимационных вмешательств, которые должны быть быстро выполнены и направлены на увеличение оксигенации при минимизации баротравмы, которая может привести к синдромам утечки воздуха: интубация и эндотрахеальная санация в родильном отделении, механическая вентиляция (традиционная или высокочастотная вентиляция), желательно, уже начатая в родильном отделении (чтобы избежать использования мешка Амбу, имеющего более высокий риск развития с-ма утечки воздуха), катетеризация пупочной вены, седация с непрерывной внутривенной инфузией фентанила и / или мидазолама, дотация сурфактанта болюсно или лаваж, ингаляции оксида азота (iNO) если присутствует персистирующая легочная гипертензия, инотропные препараты и / или трансфузия плазмы с целью коррекции артериальной гипотонии, профилактика антибиотиками (так как сепсис часто подозревается в рамках дифференциальной диагностики), противовоспалительные препараты для уменьшения воспаления легких, строгая оценка и лечение ацидоза, электролитного дисбаланса и гипогликемии. Тяжелые случаи MAS может потребовать проведения экстракорпоральной мембранной оксигенации (ЭКМО), хотя процент новорожденных, нуждающихся в ЭКМО, снизился с момента внедрения лечения персистирующей легочной гипертензии iNO. Рентгенография грудной клетки должна быть выполнена для оценки рентгенографической картины в легких и соответствию диагнозу МАS, а также для исключения пневмоторакса, пневмомедиастинума или легочной интерстициальной эмфиземы, которые часто являются осложнениями MAS. Рентгенографическая картина при MAS может включать грубые неравномерные или очаговые участки инфильтрации легких, области сниженной аэрации или консолидации (ателектазы) чередуется с зонами гиперинфляции и участками генерализованной гиперинфляции (рис. 1). Классическая картина при MAS описывается как диффузные, асимметричные пятнистые инфильтративные тени, но из-за различных механизмов, вызывающих заболевание, могут быть различные рентгенографические данные. Рентгенографический регресс изменений в легких происходит медленно в течение нескольких дней или недели, если картина соответствовала классической рентгенологической при MAS. Эхокардиография проводится для исключения врожденного порока сердца и для оценки степени легочной гипертензии, сократительной функции миокарда и сердечного выброса, оценки направления сброса по внутрисердечным шунтам справа налево и через артериальный проток.
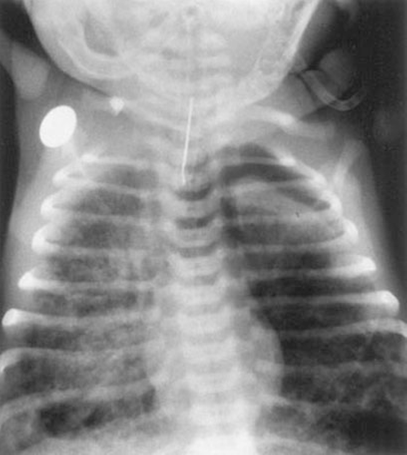
Рис. 1 Рентгенография органов грудной клетки новорожденного с с-мом аспирации мекония. Изменения могут быть оценены как грубые неравномерные или очаговые инфильтрации, асимметричные области сниженной аэрации или консолидация (ателектаз) чередующиеся с зонами гиперинфляции и левостороннего пневмоторакса. Обычно в случае MAS, первичные анализы крови характеризуются гипоксемией, метаболическим ацидозом, от умеренной до тяжелой гиперкарбии, без признаков инфекции (С-реактивный белок отрицательный, лейкоцитоз или лейкопения отсутствуют). При данном заболевании не происходит физиологического снижения сопротивления в легочной артерии с увеличением легочного кровотока, в результате чего кровь шунтируется справа налево на уровне предсердий и артериального протока, таким образом поддерживается дальнейшее прогрессирование гипоксемии и формирование порочного круга. Лейкопения может появится позже, как следствие накопления полиморфноядерных лейкоцитов в ткани легких.
Клири и Уисвелл предложили критерии определения степени тяжести МАS: (1) легкий МАS - это заболевание, которое требуется менее 40% кислорода в течение менее 48 часов, (2) умеренный MAS является заболеванием, которое требует более 40% кислорода в течение более 48 часов без развития с-ма утечки воздуха, и (3) тяжелый MAS - заболевание, которое требует вспомогательной вентиляции в течение более 48 часов и часто связан с персистирующей легочной гипертензией (Cleary and Wiswell 1998). Пневмоторакс по-прежнему является частым осложнением МАS (8–20%), и это важный индикатор плохого прогноза. Примерно 40% детей с МАS требуют ИВЛ, около 1,4% ЭКМО. Использование ЭКМО уменьшается в течение последнего десятилетия, в то время как высокочастотная осцилляторная вентиляция (HFOV) и iNO используются чаще (Singh et al. 2009). Однако, нет проспективных рандомизированных контролируемых исследований, которые бы сравнили традционную вентиляцию с HFOV при МАS. Теоретически, высокочастотная вентиляция должна уменьшить частоту развития синдрома утечки воздуха при MAS, однако на животных и клинических моделях она показала противоречивые результаты. Высокочастотная вентиляция может замедлить распространение мекония вниз по трахеобронхиальному дереву и дает больше времени для его удаления (Уолш и Фанаров 2007).
Ингибирование функции сурфактанта в альвеолярном пространстве является важным элементом патофизиологии болезни, таким образом представляется обоснованным дотация препарата экзогенного сурфактанта при MAS, изначально в виде стандартного болюса и, в последнее время, начал применятся лечебный лаваж лёгких. У детей с МАS, дотация сурфактанта может уменьшить тяжесть респираторного заболевания и уменьшить количество детей с прогрессирующей дыхательной недостаточностью, требующих поддержки в виде ECMO (El Shahed et al. 2014). Болюсное введение сурфактанта следует применять как можно раньше насколько это практически возможно у детей, которые демонстрируют значительные паренхиматозные проявления болезни в дозе минимум 100 мг / кг, одномоментно вводится в трахею. Могут применяться натуральные или синтетические препараты третьего поколения и повторять дотацию каждые 6 ч до улучшения оксигенации. Недавно появилась методика лаважа с разбавленным сурфактантом как альтернатива болюсного введения при МАS, которое имеет преимущество в удалении ингибиторов сурфактанта (гемоглобин, белки плазмы) из альвеолярного пространства в дополнение к увеличению концентрации сурфактанта в легких. Идеальный объем жидкости и техника лаважа при МАS пока не установлены; экспериментальные данные предполагают общий объем лаважа 30 мл / кг (вводится в виде двух порций по 15 мл / кг) при концентрации 5 мг / мл сурфактанта (более низкие концентрации делают сурфактант более чувствительным к инактивации) как наиболее эффективный в плане улучшения оксигенации и легочной механики при снижении травматического повреждения легких. Малый общий объем лаважа или меньшие объемы порций лаважа менее эффективно удаляет меконий, а больший общий объем лаважа приводил к недопустимо высокой водной нагрузки на легкие. Рекомендуемая процедура проводится следующим образом: (а) адекватная стабилизация новорожденного; (б) седации и миорелаксация, чтобы свести к минимуму эпизоды брадикардии и максимальное извлечение жидкости при лаваже; (в) выполнить лаваж в быстрой последовательности с инстилляцией и аспирацией каждой порции лаважа в течение 60–80 с; (d) использовать открытую санацию с рассоединением с респиратором и ручным вибрационным массажем грудной клетки, чтобы собрать как можно больше жидкости; а также (д) продолжение ИВЛ с более высоким средним давлением в дыхательных путях (на 2–4 см больше H2O), чем до лаважа в течение 30 минут, чтобы повторно рекрутировать (восстановить) объем легких и очистить их от лаважной жидкости. Процедура лаважа с большим объемом неизбежно связано с падением уровня оксигенации во время и в течение короткого времени после лаважа, поэтому должны быть проведены рандомизированные контролируемые исследования по методике и технике лаважа у новорожденных с тяжелым MAS для оценки реальных преимуществ перед потенциальными рисками, связанными с процедурой (Dargaville et al. 2008). Таким образом, эта процедура не может быть рекомендована как рутинная, хотя недавний метаанализ показывает, что она может быть полезной, уменьшая риск неблагоприятных исходов в виде смерти или использования ЭКМО (Хан и др. 2013).
МАS часто сопровождается персистирующей легочной гипертензией. iNO вызывает селективную вазодилатацию сосудов легких, воздействуя непосредственно на гладкий мышечный слой сосудов. Расширяя сосуды в хорошо вентилируемых областях легких, iNO уменьшает нарушения вентиляционно-перфузионного отношения и улучшает оксигенацию у детей с персистирующей легочной гипертензией. Эффект от назначения iNO зависит от адекватной доставки его в альвеолы; таким образом, он может быть менее эффективным у пациентов с MAS, частично из-за механического «барьера» в виде мекония для диффузии его через альвеолярную мембрану. Предварительный лаваж с сурфактантом, по-видимому, способствует доставке iNO в альвеолы с увеличением оксигенации в результате терапии (Rais-Bahrami et al. 1997). Кинселла и соавт. показали, что комбинация HFOV и iNO могут быть более эффективными, чем любая из этих методик в виде монотерапии у пациентов с MAS, вероятно, из-за улучшения инфляции легких и лучшей доставки препарата в легкие (Kinsella et al. 1997). Похоже, что iNO улучшается исход при гипоксемической ДН у доношенных и поздних недоношенных детей за счет снижения потребности в ЭКМО, но не имеет очевидное влияние на смертность (Финер и Баррингтон 2006).
С внедрением в лечение персистирующей легочной гипертензии с iNO, необходимость проведения ЭКМО снизилась. Тем не менее, около 40% детей с МАS, получавших лечение iNO, могут не отвечать на терапию и требовать эскалации вмешательств. ЭКМО все еще считается важным инструментом в лечении новорожденных с МАS и критической дыхательной недостаточностью, с самой высокой выживаемостью при любом состоянии новорожденного до ЭКМО (порядка 93–100%). Несмотря на доказательства, указывающие на эффективность ЭКМО при тяжелых МАS, не вызывая повышения легочной или неврологической заболеваемости (из-за длительной гипоксии), некоторые дети до сих пор получают ЭКМО запоздало. Недавнее внедрение новых методов лечения дыхательной недостаточности у новорожденных с MAS, таких как iNO, сурфактант и HFOV могут определить более длительный курс до ЭКМО у детей, не отвечающих на эти методы лечения. Задержка начала ECMO более чем на 96 часов приводит к значительному увеличению продолжительности ЭКМО и длительности вентиляции после ЭКМО, а также значительному увеличению смертности в этой группе новорожденных. Таким образом, необходимость ЭКМО при тяжелом МАS следует прогнозировать как можно раньше, чтобы избежать ассоциированной с ИВЛ травмы легких и для улучшения исходов (Kugelman et al. 2005).
Другими потенциальными терапевтическими вмешательствами для лечения МАS являются: синтетический сурфактант, каптоприл, тезосентан и пентоксифиллин. Некоторые сурфактанты могут быть более устойчивыми к инактивации меконием (Herting et al. 2001); Поиск нового синтетического сурфактанта, обладающего высокой устойчивостью к инактивации меконием и эффективным при других формах токсического пневмонита проводится постоянно.
При МАS воспаление играет важную роль в патогенезе повреждения легких. Спектр противовоспалительных агентов был исследован для внедрения для данной терапевтической цели, таких как кортикостероиды, пентоксифиллин и аминофиллин. Кокрановский систематический обзор имеющихся клинических испытаний заключает, что нет достаточных доказательств использования системных стероидов в лечении MAS (Ward and Sinn 2003). В недавнем рандомизированном контролируемом исследовании, однако, были применены внутривенный метилпреднизолон и ингаляционный Будекорт, которые продемонстрировали способность подавлять уровень TNF-α в аспирате трахеи у новорожденных с МАS. Данные дети меньше находились в стационаре, имели более короткую зависимость от дополнительного кислорода и более ранний радиологический регресс изменений при МАS в легких (Tripathi и Saili 2007). Локальное введение кортикостероидов, как ингаляционных, так и вводимых интратрахеально (Будесонид), может привести к тем же преимуществам с меньшими побочными эффектами, чем назначение системных кортикостероидов. На самом деле, недавнее рандомизированное контролируемое исследование показало, что ингаляции с будесонидом доношенных детей с MAS способствует регрессу дыхательной недостаточности с меньшей потребностью в кислороде и, таким образом, более ранним переводом из ОРИТН по сравнению с контрольной группой (Гарг и другие. 2016).
При остром повреждении легких после аспирации мекония, легочная гипертензия связана с повышением уровня эндотелина (ET) -1. В недавнем исследовании тезосентан назначенный внутривенно как двойной антагонист рецепторов ЭТА и ЭТБ продемонстрировал улучшение легочного газообмена и гемодинамики посредством снижения среднего артериального давления в легочной артерии и легочного сосудистого сопротивления в экспериментальной модели аспирации мекония. Таким образом, Тезосентан действует преимущественно на стенку легочных сосудов, препятствуя эффектам ET-1, и его действие будет усиливаться при сочетанной терапии с ингаляционным илопростом (Geiger et al. 2008).
Гибель клеток в результате апоптоза в легких продемонстрирована при MAS. Индуцированный меконием апоптоз активируется сильным вазоконстриктором, ангиотензином II, который является продуктом превращения ангиотензина I ангиотензин-превращающим ферментом (АПФ) внутри клетки. Предварительное лечение каптоприлом, блокирующим превращение ангиотензина I в апоптоз-индукцируемый ангиотензин II, значительно ингибирует вызванный меконием апоптоз клеток легких, а также снижает смертность кроликов от MAS. Каптоприл может представлять новое потенциальное терапевтическое вмешательство при МАS (Загария и др. 2006).
Более эффективные методы лечения значительно улучшили выживаемость детей с МАS за последние три десятилетия, но количество заболеваемости среди выживших, по видимому, не изменилась, и существует растущая обеспокоенность в отношении плохих долгосрочных неврологических и легочных исходов у новорожденных даже не имеющих симптомов на момент выписки из стационара.