Определение гидроксида натрия в образце каустической соды методом
потенциометрического титрования
Цель: Определить массовое содержание гидроксида натрия в образце каустической соды методом потенциометрического титрования при построении калибровочного графика.
Посуда и принадлежности: потенциометр и ионселективный электрод
Реактивы: раствор каустической соды, соляной кислоты
Задание: выполните измерения, построить график, оформить отчёт.
Правила техники безопасности:
1. Правила работы с реактивами.
2. Правила работы с химической посудой.
3. Правила работы с измерительными приборами.
Методические указания к выполнению лабораторной работы:
Кривая потенциометрического титрования – это зависимость величины рН или ЭДС (Е) гальванического элемента (ось ординат, В) от объема прилитого рабочего раствора (ось абсцисс, мл).
Концентрация определяемых ионов изменяется в зависимости от объема прибавленного раствора неравномерно: сначала это изменение невелико, затем становится более заметным и, наконец, в точке эквивалентности достигает наибольшего значения.
Вместо обычных кривых, показывающих зависимость величины электродного потенциала (или рН) от объема прилитого рабочего раствора при потенциометрическом титровании часто используют так называемые дифференциальные кривые – кривые зависимости отношения DE/DV от объема прилитого при титровании рабочего раствора, где ∆Е – изменение значения величины электродного потенциала (мВ), а ∆V – объема титранта (мл) между последующей порцией добавленного рабочего раствора и предыдущей. На дифференциальной кривой точку эквивалентности определяется по ее пику.
Суть метода заключается в том, что в исследуемый раствор погружают гальванический элемент, состоящий из электрода сравнения и индикаторного электрода (или современный комбинированный электрод) и титруют раствор, определяя ЭДС (мВ) гальванического элемента в ходе титрования. По данным титрования строят кривую титрования в координатах Е = f (Vр.р, мл) или дифференциальную кривую титрования в координатах D E /D V - Vр.р, (мл). По кривой титрования находят объем рабочего раствора, эквивалентный 66 содержанию определяемого в пробе вещества. По эквивалентному объему рассчитывают содержание определяемого вещества в анализируемой пробе.
Ход работы:
1. Для определения массового содержания гидроксида натрия в образце каустической соды взять навеску каустической соды массой 0,2418 г, растворить в мерной колбе на 50 мл, объем раствора в колбе довести до риски и тщательно перемешать. Из приготовленного раствора отобрать аликвоту 5 мл и оттитровать потенциометрически 0,1 н раствором соляной кислоты. Данные потенциометрического титрования свести в таблицу результатов.
2. По полученным результатам потенциометрического титрования рассчитать массовое содержание гидроксида натрия (%) в образце каустической соды.
3. Используя таблицу результатов потенциометрического титрования построить дифференциальную кривую, откладывая по оси абсцисс значения объема прилитого рабочего раствора соляной кислоты (V HCl, мл), а по оси ординат – значение отношения изменения величины электродного потенциала от изменения объема прилитого к аликвоте каустической соды рабочего раствора соляной кислоты: D E /D V.
Таблица Результаты определения
Зависимость величины электродного потенциала от концентрации хлоридов
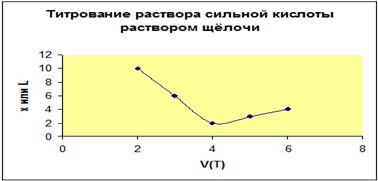
Точка эквивалентности определяется по пику на кривой титрования, отвечающему эквивалентному объему рабочего раствора соляной кислоты, пошедшему на титрование пробы каустической соды V HCl экв. = мл. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изм | Лист | № докум | Подп. | Дата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Расчет массового содержания (%) гидроксида натрия NaOH в образце каустической соды ведется по формуле: где: - CN HCl – нормальная концентрация рабочего раствора соляной кислоты; 0,1 г-экв/л; - г-экв NaOH – химический эквивалент гидроксида натрия; 40,00 г/моль; - VHCl (экв) – объем HCl, пошедший на титрование; определяется по пику на дифференциальной кривой титрования; мл; - Vмерной колбы – объем мерной колбы, в которой готовился анализируемый раствор каустической соды; 50 мл; - Vаликвоты - объем раствора каустической соды, взятый для титрования Вывод: Массовое содержание гидроксида натрия NaOH в образце каустической соды составляет 97,60 %. Контрольные вопросы 1. Какие величины измеряют потенциометры? 2. Какие электроды использует потенциометрия? 3. Рассказать технику проведения данного потенциометрического определения. 4. Техника безопасности при измерениях. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изм | Лист | № докум | Подп. | Дата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изм | Лист | № докум | Подп. | Дата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изм | Лист | № докум | Подп. | Дата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
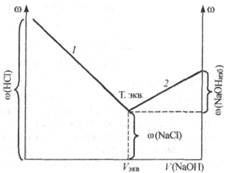
Титрование смеси кислот: сильной (НСl) и слабой
(СН3СООН) — раствором сильного основания (NaOH). Так как
присутствие сильной кислоты подавляет диссоциацию слабой, то
электрическая проводимость исследуемого раствора до начала
титрования определяется только содержанием сильной кислоты
и является достаточно высокой. Из-за различия в силе кислот
нейтрализация раствора при титровании протекает в две стадии,
причем сначала нейтрализуется сильная кислота, затем слабая:
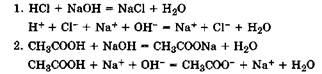
Нейтрализация сильной кислоты на первом этапе титрования (линия 1) ведет к снижению электрической проводимости раствора (рис. 24.5), причины которого уже рассматривались выше. Окончанию первой стадии нейтрализации соответствует точка эквивалентности I. Электрическая проводимость раствора в этот момент определяется содержанием NaCl, вклад слабой кислоты в суммарную проводимость системы очень мал.
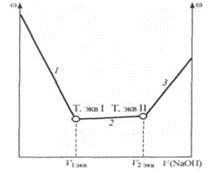
 На втором этапе титрования, соответствующем нейтрализации СН3СООН и образованию соли CH3COONa (линия 2), электрическая проводимость незначительно повышается, так как кроме ионов соли NaCl в переносе заряда начинают участвовать ионы другой соли - CH3COONa. Окончанию этого этапа титрования отвечает точка эквивалентности И. В этот момент раствор содержит смесь двух солей: CH3COONa и NaCl. Поскольку нейтрализация закончилась, то дальнейшее добавление титранта NaOH приводит к появлению в растворе дополнительного количества ионов, в том числе высокоподвижных ионов ОН", за счет чего электрическая проводимость раствора резко возрастает (линия 3).
На втором этапе титрования, соответствующем нейтрализации СН3СООН и образованию соли CH3COONa (линия 2), электрическая проводимость незначительно повышается, так как кроме ионов соли NaCl в переносе заряда начинают участвовать ионы другой соли - CH3COONa. Окончанию этого этапа титрования отвечает точка эквивалентности И. В этот момент раствор содержит смесь двух солей: CH3COONa и NaCl. Поскольку нейтрализация закончилась, то дальнейшее добавление титранта NaOH приводит к появлению в растворе дополнительного количества ионов, в том числе высокоподвижных ионов ОН", за счет чего электрическая проводимость раствора резко возрастает (линия 3).
|
Таким образом, кривая титрования смеси сильной и слабой одноосновных кислот содержит три ветви и имеет две точки эквивалентности.
Рис. 24.5. Кривая кондуктометрического титрования смеси сильной и слабой кислот сильным основанием
Кондуктометрическое титрование особенно полезно при работе с окрашенными и мутными растворами, когда употребление индикаторов исключено. Кондуктометрические методы исследования удобны тем, что они, во-первых, являются неразрушающими, во-вторых, характеризуются простотой исполнения и экспрессностью.