Оформляете работу, как всегда (заводим тонкую тетрадь).
Пишем теоретическую часть, (то что выделено желтым) а затем практическую, заполняя третью колонку. Уравнения обязательны.
Отправлять работу не нужно. Предоставите ее на уроке.
Лабораторная работа № 13
Тема. Кислородсодержащие органические соединения. Карбоновые кислоты.
Цель: закрепить теоретические знания, изучить химические свойства кислородсодержащих органических соединений на основе опытно - экспериментальной работы; развивать умение использовать лабораторное оборудование, фиксировать результаты, делать выводы; воспитывать познавательный интерес химии.
Оборудование: Вещества: спирты: этиловый, пропиловый, изопропиловый, глицерин, этиленгликоль; раствор сульфата меди (II); оксид меди (II); концентрированный раствор серной кислоты; концентрированная уксусная кислота, 1% раствор перманганата калия; раствор гидроксида натрия; раствор йода в йодистом калии; раствор фенолфталеина; карбонат натрия, муравьиная кислота, лакмус синий, цинк; медная проволока; песок. набор пробирок, пробка с газоотводной трубкой, стаканчик (100 мл), пипетка, спиртовка.
Проблема для разрешения в работе. Каково влияние функциональных групп на свойства органических соединений.
! При изучении теоретической части, как и в спиртах, обратите внимание на роль функциональной группы.
Теоретическая часть
Карбоновые кислоты - органические соединения, в молекулах которых содержатся одна или несколько карбоксильных групп, соединённых с углеводородным радикалом или атомом водорода
Классификация карбоновых кислот.
1. Одноосновные, двухосновные и многоосновные (в зависимости от числа функциональных групп).
2. Предельные, непредельные и ароматические (в зависимости от строения радикала).
О
 |
3. Общая формула предельных одноосновных кислот: R- С
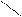
ОН
Атом «Н» в группе «- OH» в кислотах гораздо более подвижен, чем в молекулах спиртов. Поэтому растворимые в воде карбоновые кислоты диссоциируют.
Номенклатура.
а) исторически сложившиеся названия кислот: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, энантовая;
б) по международной номенклатуре - от названий соответствующих углеводородов + "овая" с прибавлением слова "кислота".
Пример: Н-СООН муравьиная или метановая, СН3-СООН уксусная или этановая кислоты.
Химические свойства.
1. Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации: R–COOH → R–COO- + H+
Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2СH3COOH + Mg → (CH3COO)2Mg + H2
2СH3COOH + СaO → (CH3COO)2Ca + H2O
H–COOH + NaOH → H–COONa + H2O
2СH3CH2COOH + Na2CO3 → 2CH3CH2COONa + H2O + CO2
Применение.
Муравьиная кислота – в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров).
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
! Данная практическая работа требует внимательного отношения к работе с реактивами – это кислоты. Будьте аккуратны сами, не забывайте о тех, кто находится рядом с вами.
! Оформляйте опытную часть работы в соответствии с требованиями. В выводах подчеркивайте именно свойства кислот, в отличие от других кислородсодержащих органических веществ.
Практическая часть. Опытная
| Опыт 1. Определение кислотности раствора. | В первую пробирку с раствором уксусной кислоты добавьте кусочек лакмуса и понемногу добавляйте щёлочь. | Запишите, что наблюдаете. |
| Опыт 2. Взаимодействие карбоновых кислот с металлами. | В одну пробирку с уксусной кислотой опустите гранулу цинка, а в другую – стружки магния. | Запишите, что наблюдаете. Напишите уравнения. |
| Опыт 3. Взаимодействие карбоновых кислот с оксидами. | В пробирку с муравьиной кислотой добавьте немного оксида меди (II) и подогрейте ее. | Запишите, что наблюдаете. Напишите уравнение реакции. |
| Опыт 4. Взаимодействие карбоновых кислот с солями. | В пробирку с уксусной кислотой на кончике шпателя внесите кристаллической соды. | Запишите, что наблюдаете. Напишите уравнение реакции. |
| Опыт 5.Отношение олеиновой кислоты к бромной воде и к раствору перманганата калия. | В две пробирки с олеиновой кислотой добавьте по 1-2 капли бромной воды в одну и столько же раствора перманганата калия. Обе пробирки встряхните. | Отметьте, что наблюдали. Объясните, почему при взаимодействии олеиновой кислоты с бромной водой и перманганатом калия происходит обесцвечивание раствора. |
Выводы по работе. Можете использовать следующий алгоритм:
- я уточнил для себя…;
-я совершенствовал умения…;
-я научился…
В ходе работы проблема разрешена. (Далее следует объяснение