в доменных и ферросплавных печах
в.Е. Рощин, А.В. Рощин
Южно-Уральский государственный университет (НИУ), г. Челябинск
roshchinve@susu.ru
«...механизм химических процессов может быть понят лишь на основе физических теорий, описывающих движение реагирующих молекул и осуществляющих акт химической реакции электронов» [1]
 Существующие варианты теории твёрдофазного восстановления железа базируются на атомно-молекулярных представлениях и рассматривают восстановление как обмен между молекулами оксидов и восстановителем атомами кислорода. Но в твёрдых оксидах и металлах нет ни атомов, ни молекул, есть только ионы и связывающие их электроны. Окислительно-восстановительные реакции – это процесс обмена не атомами, а электронами. Поэтому с позиций атомно-молекулярных представлений невозможно создать непротиворечивую теорию процессов, протекающих на другом – электронном уровне.
Существующие варианты теории твёрдофазного восстановления железа базируются на атомно-молекулярных представлениях и рассматривают восстановление как обмен между молекулами оксидов и восстановителем атомами кислорода. Но в твёрдых оксидах и металлах нет ни атомов, ни молекул, есть только ионы и связывающие их электроны. Окислительно-восстановительные реакции – это процесс обмена не атомами, а электронами. Поэтому с позиций атомно-молекулярных представлений невозможно создать непротиворечивую теорию процессов, протекающих на другом – электронном уровне.
Развиваемая авторами электронная теория восстановления описывает электро- и массоперенос в газовой и конденсированных фазах, обмен электронами между восстановителем и оксидом, перераспределение электронов между катионами и анионами в решётке оксида и превращение кристаллической решётки оксида в решётку металла, а также влияние на эти процессы давленияи температуры. Согласно теории непосредственным результатом извлечения одного аниона кислорода из кристаллической решётки на поверхности оксида является образование анионной вакансии и двух связанных с ней свободных электронов. В комплексных и бедных рудах вакансии и электроны рассеиваются в объёме оксида, накапливаются и сливаются у катионов, уровень Ферми которых ниже химического потенциала электронов в вакансиях.
Известные из экспериментов и практики получения чугуна и ферросплавов результаты объяснены участием в окислительно-восстановительных реакциях в слое твёрдых реагентов заряженных частиц низкотемпературной плазмы. Плазма образуется вследствие термоэлектронной эмиссии с поверхности восстановителя и термической ионизации газов. Показано, что карботермическое восстановление активных металлов, а также железа из прочных комплексных оксидов происходит только твёрдым углеродом. При этом через плазму осуществляется встречный перенос углерода на поверхность оксида и оксида на поверхность углерода, в результате которого на поверхности каждого из них образуются оболочки карбидов. Образование карбидов отравляет поверхность, тормозит и останавливает восстановление. Оплавление и стекание материала оболочек переводит восстановление в кинетический режим и обеспечивает его эффективное протекание.
Ключевые слова: получение чугуна, получение ферросплавов, теория восстановления, термоэлектронная эмиссия, термическая ионизация, электрон-ионный обмен, низкотемпературная плазма
Атомно-молекулярные представления о механизме восстановления. Существующая теория металлургических процессов активно разрабатывалась в первой половине прошлого века на базе сложившихся к тому времени молекулярных представлений о механизме химических реакций. Поэтому она описывает процессы восстановления металлов из руд химическими реакциями, протекающими между молекулами и атомами на поверхности контакта восстановителей с оксидами руд. Согласно теории восстановление осуществляется путём обмена атомами кислорода между молекулами (атомами) восстановителя и молекулами оксидов. При этом само собой разумеющимся считается, что и продукты реакций образуются на этой же поверхности.
Исходя из этих представлений и учитывая последовательность отнятия атомов кислорода у молекул оксидов одного за другим, в 20-х годах прошлого века академик А.А. Байков сформулировал положение, согласно которому высшие оксиды должны превращаться сначала в промежуточные, затем в низшие оксиды и, наконец, в металл [2]. Принцип последовательного превращения высших оксидов в металл через все возможные стадии образования промежуточных оксидов известен как принцип Байкова [3-9], он лежит в основе существующей атомно-молекулярной теории восстановления и сомнению не подвергается.
При получении чугуна и большинства ферросплавов в качестве основного восстановителя железа и целевых металлов (хрома, марганца, кремния и других) ферросплавов используется кокс. Поэтому восстановление описывают реакцией между молекулой твёрдого оксида руды и атомом углерода твёрдого кокса с образованием атома твёрдого металла и газовой молекулы монооксида углерода Ме Отв + Ств = Ме тв + СОгаз. Но поскольку твёрдые тела контактируют между собой только в отдельных точках, ничтожно малая, при том постоянно нарушаемая в результате химического взаимодействия, площадь точечного контакта исходных реагентов не позволяет удовлетворительно объяснить наблюдаемую на практике высокую скорость восстановления. Кроме того, уже первые порции твёрдых продуктов реакции разделяют исходные твёрдые реагенты и затрудняют подвод атомов и молекул к месту её протекания. Попытки обосновать контактный (прямой) механизм твёрдофазного восстановления с наблюдаемой скоростью особыми условиями диффузии атомов и молекул в разделяющей реагенты металлической прослойке, активно предпринимавшиеся в первой половине прошлого века, успехом не увенчались. Поэтому контактный механизм прямого восстановления металлов углеродом в настоящее время практически уже не рассматривается, во всяком случае, применительно к восстановлению железа в доменном процессе.
В связи с этим признание получило высказанное еще в 1872 году французским металлургом Л. Грюнером [10] предположение о ключевой роли в процессах карботермического восстановления железа промежуточного реагента – газообразного монооксида углерода. Согласно этой точке зрения на поверхности кусков руды протекает реакция Ме Отв + СОгаз = Ме тв + СО2газ. Образующийся диоксид углерода при температуре выше 700...800К [7] взаимодействует с твёрдым углеродом по реакции Будуара с образованием монооксида СО2газ + Ств = 2СО. Сумма этих двух реакций даёт реакцию прямого восстановления металла твёрдым углеродом Ме Отв + Ств = Ме тв + СОгаз.
При такой (бесконтактной) схеме на восстановление с участием промежуточного газового реагента расходуется твёрдый углерод кокса. Поэтому в учебной и научной литературе [3-6] этот двухступенчатый (или биреакционный) процесс восстановления также называют прямым восстановлением в отличие от косвенного газового восстановления тем же монооксидом углерода, но при температуре ниже 700К, когда регенерация монооксида из диоксида невозможна. За показатель косвенного восстановления принимается наличие в газовой фазе молекул СО2, а о степени развития прямого и косвенного восстановления судят по соотношению концентраций СО и СО2 в газовой фазе.
Учитывается также [4-7], что твёрдый углерод расходуется на восстановление и в том случае, когда непосредственным восстановителем является газообразный водород по реакции Ме Отв + Н2газ = Ме тв + Н2Огаз. При температуре выше 1083К влага, вносимая в доменную печь шихтой и воздухом дутья, а также вода, образующаяся по реакции восстановления водородом, разлагаются твёрдым углеродом с образованием СО и Н2 по реакции Н2Огаз+ Ств = СОгаз + Н2газ. В результате, несмотря на то, что непосредственным восстановителем в этом случае является водород, он регенерирует и практически не расходуется, то есть участвует только в так называемых транспортных реакциях [11]. Поскольку и в этом случае расходуемым компонентом является только твёрдый углерод, то восстановление и водородом при температуре выше 1083К также относят к прямому восстановлению [3-8].
При температуре ниже 1083К водород обладает меньшим сродством к кислороду по сравнению с монооксидом углерода, поэтому в этих условиях протекает реакция взаимодействия паров воды уже с монооксидом углерода Н2Огаз + СОгаз = СО2газ + Н2газ, в результате которой снова образуется водород. Но поскольку монооксидом углерода разлагается не вся вода, а только до равновесных парциальных давлений, то конечным результатом восстановления металла водородом помимо металла является СОгаз и Н2Огаз. Соотношение концентраций (СО + Н2):(СО2 + Н2О) в доменном газе используют как интегральный показатель развития процессов прямого и косвенного восстановления, а исходя из возможности регенерации газовых восстановителей твёрдым углеродом выделяют температурные интервалы прямого и косвенного восстановления – выше 800К восстановление считают прямым, ниже этой температуры – косвенным.
Таким образом, согласно существующим представлениям о механизме восстановления металлов из твёрдых оксидов твёрдым углеродом предполагается бесконтактный обмен атомами кислорода между оксидами и коксом, последовательное превращение высших оксидов в металл через все возможные промежуточные оксиды, протекание восстановительных реакций на поверхности твёрдых реагентов, обязательное участие в процессе восстановления газовых молекул, регенерация газовых молекул непосредственных восстановителей твёрдым углеродом, образование металлической фазы на месте протекания химической реакции восстановления металла из оксида, то есть на поверхности оксида.
«Молекулярный» подход к процессу восстановления влечёт за собой необходимость описания не только механизма обмена твёрдых реагентов молекулами и атомами через газовую фазу, но и анализ взаимодействия газовых молекул с молекулами твёрдых тел на их поверхности, а также перемещения молекул и атомов к поверхности реагирования через твёрдые продукты восстановления и в объёме твёрдых оксидов. Для описания стадий процесса восстановления металла на поверхности твёрдых оксидов газовыми молекулами преимущественно отечественными учёными разработана так называемая адсорбционно-автокаталитическая теория восстановления железа углеродом, реализуемого с участием промежуточных агентов – газовых молекул СО и Н2 [12-14]. Согласно этой теории восстановление металла на поверхноти оксида проходит в 3 стадии: I – адсорбция газа-восстановителя на активных центрах (зародышах металла), II – химическая реакция на поверхности оксида, III – десорбция продукта восстановления с поверхности оксида.
Адсорбционно-автокаталитическая теория восстановления обычно дополняется диффузионно-кинетической теорией [15], согласно которой восстановление контролируется подводом реагентов к месту протекания химической реакции на поверхности оксида. В этой теории для обоснования наблюдаемой на практике большой скорости восстановления предполагается возможность быстрой встречной диффузии газовых молекул СО и СО2 в металле и оксидах по микропорам, размер которых соизмерим с размером молекул – так называемой кнудсеновской диффузии.
Поэтому в основе атомно-молекулярной теории восстановления лежат принцип последовательного превращения оксидов в металл, алсорбционно-автокаталитическая теория газового восстановления и диффузионно-кинетическая теория движения газовых молекул по микропорам в твёрдых металлической и оксидной фазах.
Мифы и проблемы атомно-молекулярных теорий. Изложенные теоретические положения разрабатывались на основе результатов исследования процессов восстановления железа из его оксидов или богатых железных руд применительно к практике работы доменных печей. Но углерод в качестве восстановителя в виде кокса широко используется также в рудотермических печах при производстве ферросплавов с активными металлами, в том числе феррохрома, ферромарганца, ферросилиция и других. Поэтому положения теории карботермического восстановления должны соблюдаться и при производстве этих ферросплавов. Между тем, монооксид углерода в ряде случаев является недостаточно сильным восстановителем и, в отличие от твёрдого углерода, не может восстанавливать более активные по сравнению с железом металлы, например хром [16]. Тем не менее, хотя описанные выше положения адсорбционно-автокаталитической теории при производстве ферросплавов реализованы быть не могут, их используют и при описании процессов восстановления в рудотермических печах [16-19].
Кроме того, и практика работы современных доменных печей не подтверждает ряда положений изложенных теоретических представлений. Например, хорошо известно, что повышение температуры дутья и давления в печи повышают технико-экономические показатели работы доменных печей, в том числе увеличивается их производительность, снижается расход кокса и т.д. [6, 20, 21]. Но совершенно очевидно, что повышение температуры усиливает тепловое движение атомов и молекул и, тем самым, ухудшает условия адсорбции, что, согласно адсорбционно-автокаталической теории, должно приводить к противоположному результату. А повышенное давление газов в печи в соответствии с принципом Ле-Шателье должно препятствовать ключевой реакции прямого восстановления Ме Отв + Ств = Ме тв + СОгаз, так как по этой реакции из конденсированных фаз образуется газ.
Существующая теория восстановления не учитывает также ни изменения в строении твёрдых тел, происходящие при нагреве в восстановительных агрегатах, ни в поведении молекул и атомов при нагреве и повышении давления газов. Но повышение температуры твёрдых тел более чем на тысячу градусов, а газов даже более чем на две тысячи градусов, и кратное увеличение давления газов в современных доменных печах не может не вызывать изменений в кристаллической структуре твёрдых тел и поведении газов.
Не выдерживает критики и диффузионно-кинетическая теория, основанная на кнудсеновской диффузии. Как уже отмечалось, в начале прошлого века для проверки возможности быстрого подвода реагентов к месту протекания реакций детально исследовалась возможность быстрой диффузия атомов или ионов в твёрдых оксидах и твёрдом металле. При этом надёжно установлено, что ни диффузией атомов, ни диффузией ионов нельзя обосновать наблюдаемую скорость реакции восстановления. В то же время диффузионно-кинетическая теория обосновывает такую высокую скорость встречной диффузией крупных двух- и трёхатомных молекул СО и СО2 по до сих пор не обнаруживаемым современной техникой микропорам.
Для преодоления явных противоречий существующих теорий и в попытках «приспособить» их к конкретным случаям восстановления разных металлов из разных руд в тех или иных условиях предпринимались и до сих пор продолжаются попытки дополнить и уточнить эти теории. Например, авторы работ [16-19] разрабатывают «газофзно-твёрдофазный» механизм восстановления, а авторы [22-24] пытаются обосновать так называемую диссоционно-адсорбционную теорию, объединяя в единый механизм невозможные в одних тех же условиях процессы адсорбции и диссоциации. Поскольку по термодинамическим условиям восстановление хрома невозможно объяснить участием СО, роль восстановителя отводят газовым радикалам (CH4 газ , CH3 газ , CH2 газ , CH газ, C газ, H газ) [16-19] или промежуточным оксидам углерода, например «недоокиси» С3О2 [18, 25, 26], переносящих углерод восстановителя на поверхность оксида с образованием особо активного углерода С*, парам восстанавливаемых оксидов или парам образующихся в результате их диссоциации низших оксидов [27-30], которые переносят восстанавливаемый компонент на поверхность твердого восстановителя, где развивается прямое (контактное) восстановление («газо-карбидный» вариант теории). Другими словами, предполагается, что в зависимости от химической активности восстанавливаемого металла, типа используемых руд и восстановителей разные металлы в разных условиях восстанавливаются по разным механизмам, в связи с чем единой теории восстановления металлов вообще не может быть [31].
Следует обратить внимание также на то, что ни изложенные выше базовые положения существующей теории восстановления, ни многочисленные «уточняющие» и «дополняющие» её варианты не уделяют внимания ключевым моментам восстановления, а именно процессам перестройки кристаллической решётки оксидов в кристаллическую решётку металлов. А ведь это именно те процессы, которые обязательно должны быть реализованы во всех случаях восстановления и что, несомненно, является общим при любом наборе условий восстановления.
Недостатки и противоречия существующей теории по нашему мнению обусловлены тем, что окислительно-восстановительные реакции – это не обмен молекул атомами, а обмен ионов электронами, движение и распределение которых, в том числе в ионных структурах оксидов и металлов, подчиняются законам не ньтоновской, а квантовой физики. Существующие теории восстановления – это попытки описать молекулярными закономерностями процессы, протекающие на более тонком структурном уровне. В твёрдых телах нет ни молекул, ни атомов, молекулы и атомы самостоятельно существуют только в газах, а кристаллическая решётка и оксидов и металлов образована ионами, связанными «валентными» электронами. Выделить отдельные молекулы или атомы в кристаллической решётке с ионной и металлической связью невозможно [32-34].
 Так, даже в примитивной кристаллической решётке типа NaCl с ионной связью каждый катион натрия связан своим единственным валентным электроном сразу с 6-тью анионами хлора, а каждый анион хлора связан с 6-тью катионами натрия (рис. 1, а). В объёмно-центрированной решётке типа CsCl каждый катион одним валентным электроном одновременно связан с 8-мью анионами (рис. 1, б), а в плотнейших упаковках (гранецентрированных кубических и гексагональных плотноупакованных) каждый ион одновременно взаимодействует с 12-тью ионами противоположного знака. В оксидах всегда более крупным анионам кислорода свойственна плотнейшая упаковка (рис. 1, в). Катионы, имеющие меньшие размеры, располагаются в тетра- и октапорах, причём часто наряду с восстанавливаемыми катионами, например железа и хрома, в этих же порах находятся катионы невосстанавливаемых металлов, например магния и алюминия в хромовой шпинели (рис. 1, г и д). Так что при восстановлении железа и хрома в процессе производства углеродистого феррохрома углерод в принципе не может вступать в реакции ни с молекулами оксида железа, ни с молекулами оксида хрома.
Так, даже в примитивной кристаллической решётке типа NaCl с ионной связью каждый катион натрия связан своим единственным валентным электроном сразу с 6-тью анионами хлора, а каждый анион хлора связан с 6-тью катионами натрия (рис. 1, а). В объёмно-центрированной решётке типа CsCl каждый катион одним валентным электроном одновременно связан с 8-мью анионами (рис. 1, б), а в плотнейших упаковках (гранецентрированных кубических и гексагональных плотноупакованных) каждый ион одновременно взаимодействует с 12-тью ионами противоположного знака. В оксидах всегда более крупным анионам кислорода свойственна плотнейшая упаковка (рис. 1, в). Катионы, имеющие меньшие размеры, располагаются в тетра- и октапорах, причём часто наряду с восстанавливаемыми катионами, например железа и хрома, в этих же порах находятся катионы невосстанавливаемых металлов, например магния и алюминия в хромовой шпинели (рис. 1, г и д). Так что при восстановлении железа и хрома в процессе производства углеродистого феррохрома углерод в принципе не может вступать в реакции ни с молекулами оксида железа, ни с молекулами оксида хрома.
Исходя из изложенного, общая теория восстановления должна описывать не только механизм массообмена между восстановителем и оксидом, то есть движение молекул и атомов в газовой фазе или перемещение катионов и анионов в фазах конденсированных, но также механизм обмена электронами между восстановителем и катионами металла, перераспределение электронов между катионами и анионами в решётке оксида и превращение кристаллической решётки оксида в кристаллическую решётку металла, а также влияние на эти процессы внешних факторов (P и Т). Поэтому в данной работе поставлена цель на основе обобщения результатов собственных исследований и анализа известных литературных данных уточнить механизм восстановительных процессов при производстве чугуна и ферросплавов.
Подвижность ионов в кристаллической решётке оксидов. Отмеченные выше неудачные попытки обосновать контактный механизм восстановления твёрдым углеродом в значительной степени были обусловлены тем, что подвижность ионов в кристаллической решётке оксидов оценивалась с тех же позиций, что и в решётке металлов. При этом решающую роль при оценке скорости перемещения отводили размерам частиц, а поскольку размеры катионов заметно меньше размеров анионов, то из этого следовал вывод о преимущественно более высокой скорости диффузии катионов. Однако, как показал анализ [35-38], это не так.
В отличие от металлов ионная решётка оксидов образована частицами не только различающимися по размерам, но и разными по знаку зарядами, а также разной степенью заполнения узлов катионной и анионной подрешёток. В частности, в 8-ми элементарных ячейках шпинели, в которых реализуется полный набор узлов анионной и катионной подрешёток, содержится 32 аниона кислорода, 64 тетраэдрические и 32 октаэдрические поры, в которых могут размещаться катионы. Из 96 пор катионами заполнено всего 24 – 16 октаэдрических и 8 тетраэдрических, а 72 остаются пустыми. Казалось бы, наличие такого количества потенциально свободных мест обеспечивает несомненные преимущества для диффузии катионов, тем более, что при повышении температуры нормальные шпинели превращаются в обращённые, в которых двух- и трёхзарядные катионы меняются местами.
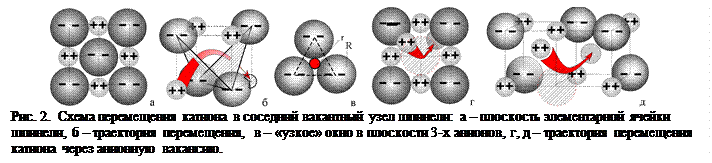 Однако для перехода в любой вакантный узел катион должен дважды «протиснуться» через узкое «окно» (r = 0,15R, где R – радиус аниона) между частицами с противоположным зарядом (рис. 2, а-в), что делает этот переход при заполненных узлах анионной подрешётки маловероятным. В то же время практически соприкасающимся анионам при тепловых колебаниях нет никаких затруднений для перескока из одного анионного узла в любой соседний узел даже при отсутствии вакантных анионных узлов. Условия перехода катиона в вакантный катионный узел существенно улучшаются при наличии даже одиночной анионной вакансии (рис. 2, г, д). Таким образом, диффузия катионов практически определяется не размерами катионов или количеством катионных вакансий, а наличием и количеством анионных вакансий.
Однако для перехода в любой вакантный узел катион должен дважды «протиснуться» через узкое «окно» (r = 0,15R, где R – радиус аниона) между частицами с противоположным зарядом (рис. 2, а-в), что делает этот переход при заполненных узлах анионной подрешётки маловероятным. В то же время практически соприкасающимся анионам при тепловых колебаниях нет никаких затруднений для перескока из одного анионного узла в любой соседний узел даже при отсутствии вакантных анионных узлов. Условия перехода катиона в вакантный катионный узел существенно улучшаются при наличии даже одиночной анионной вакансии (рис. 2, г, д). Таким образом, диффузия катионов практически определяется не размерами катионов или количеством катионных вакансий, а наличием и количеством анионных вакансий.
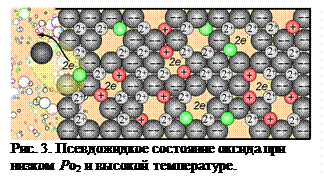 Анионные вакансии есть обязательно в любых оксидах и в любых условиях. Это, прежде всего, тепловые вакансии Френкеля и Шоттки, обусловленные тепловым движением ионов, примесные, обусловленные присутствием примесных катионов с более низким по сравнению с основными катионами зарядом, а также вакансии, вызванные нарушением стехиометрии оксидов вследствие изменения парциального давления кислорода в газовой фазе [39-43]. При понижении парциального давления кислорода в газовой фазе возможен переход из оксида в атмосферу кислорода по реакции О2– = О +Vа + 2ē с образованием в оксиде анионной вакансии и двух «лишних» электронов (рис. 3). Появление последних обусловлено тем, что кислород не может унести из оксида захваченные им электроны атома металла, так это нарушило бы равенство положительных и отрицательных зарядов в оксиде. Образование заряженных анионных вакансий или F –центров [42] (нем. Farben – краска) наблюдаемо даже визуально по изменению цвета оксидов.
Анионные вакансии есть обязательно в любых оксидах и в любых условиях. Это, прежде всего, тепловые вакансии Френкеля и Шоттки, обусловленные тепловым движением ионов, примесные, обусловленные присутствием примесных катионов с более низким по сравнению с основными катионами зарядом, а также вакансии, вызванные нарушением стехиометрии оксидов вследствие изменения парциального давления кислорода в газовой фазе [39-43]. При понижении парциального давления кислорода в газовой фазе возможен переход из оксида в атмосферу кислорода по реакции О2– = О +Vа + 2ē с образованием в оксиде анионной вакансии и двух «лишних» электронов (рис. 3). Появление последних обусловлено тем, что кислород не может унести из оксида захваченные им электроны атома металла, так это нарушило бы равенство положительных и отрицательных зарядов в оксиде. Образование заряженных анионных вакансий или F –центров [42] (нем. Farben – краска) наблюдаемо даже визуально по изменению цвета оксидов.
Соответственно изменению концентрации анионных вакансий должна меняться подвижность ионов. Например, известно, что при спекании корунда коэффициент диффузии кислорода превышает значение коэффициента его диффузии при нормальной температуре минимум на 10 порядков и приближается к значениям коэффициента диффузии в жидкостях [44]. А при низком парциальном давлении кислорода и высокой температуре суммарная концентрация анионных вакансий в твёрдых оксидах может достигать значений, при которых условия массопереноса становятся даже лучше, чем в расплавленном оксиде [45]. Такое состояние, при котором решётка благодаря связующей роли катионов в целом сохраняет устойчивость, а вследствие большого количества анионных вакансий скорость диффузии ионов достигает скорости диффузии в расплаве, характеризуется как псевдожидкое (рис. 3) [45,46]. Псевдожидкое состояние наступает, когда в ближайшем окружении каждого аниона отсутствует хотя бы один анион. Учитывая, что при плотнейшей упаковке каждый ион имеет 12 соседей, то для возникновения псевдожидкого состояния в анионной подрешётке должно быть примерно 8% вакантных узлов.
Трансформация кристаллической решётки оксида в решётку металла. Результаты экспериментов по твёрдофазному восстановлению разных металлов в бедных и комплексных рудах, анализ и обобщение результатов исследований других авторов с учётом положений химии и физики дефектных кристаллов и квантовой химии [39-43] позволила обосновать теорию восстановления металлов, базирующуюся на электронных явлениях [47-54]. Её суть сводится к тому, что непосредственным результатом химического взаимодействия восстановителя и оксида является образование на поверхности оксида в кислородной подрешётке заряженных двумя электронами восстановительных анионных вакансий.
При высокой интенсивности образования вакансий они сливаются с образованием анионной пустоты на месте их появления, то есть на поверхности оксида, в которой электронами вакансий формируется металлическая связь, минуя стадию образования атомов. Этот случай образования металлической оболочки на поверхности оксидов реализуется, в частности, при восстановлении железа в богатых рудах (рис. 4, а). При относительно малой концентрации катионов восстанавливаемых металлов в составе комплексных оксидов или в бедных рудах вакансии в результате теплового движения анионов рассеиваются в объёме оксида по общей для всех присутствующих в оксиде катионов анионной подрешётке, в том числе пересекая границы между кристаллами.

|
| Рис. 4. Возможные варианты выделения металлической фазы: на поверхности оксида (а), в объёме оксида (б), сублимация фрагментов оксида и перенос через газовую фазу на поверхность восстановителя (в) |
При наличии в катионной подрешётке катионов разных металлов с разным уровнем энергии Ферми заряженные вакансии скапливаются в местах повышенной концентрации тех катионов, уровень Ферми которых ниже химического потенциала «свободных» электронов в анионных вакансиях. В результате накопления «свободных» электронов в анионной пустоте, образующейся при слиянии восстановительных, тепловых и примесных анионных вакансий, происходит локальная перестройка катионной подрешётки с формированием металлической фазы из катионов с наиболее низким значением энергии Ферми [56-60]. В этом случае формирование металлической фазы из катионов определённого сорта происходит в объёме исходной оксидной фазы на удалении от поверхности оксида (рис. 4, б).
  
|
| Рис. 5. Последовательные этапы (а-г) формирования и вид частиц железа (д, е), выделившихся в объёме оксидной фазы из матрицы энстатита (Mg,Fe)SiO3 и кристаллов форстерита 2(Mg,Fe)SiO4 с разной концентрацией примесных катионов железа. |
Поскольку новая фаза на первых порах представляет собой дефект исходной кристаллической решётки, то её образование не вызывает термодинамических затруднений, обусловленных упругой деформацией решётки исходной фазы и межфазным натяжением, подобно тому, как это происходит, например, при плавлении кристаллов [61]. Поэтому рост новой фазы контролируется только потоками к её поверхности соответствующих катионов из ближайших объёмов оксидной фазы и заряженных анионных вакансий, образующихся в результате химической реакции на поверхности оксида. Плотность распределения и размер частиц металла в этом случае определяется интенсивностью поступления вакансий с поверхности и катионов из ближайших объёмов оксидной фазы (рис. 5).
При восстановлении многозарядных катионов Ме3+...Ме6+ поверхность оксида может насыщаться вакансиями постепенно и постепенно уменьшаться заряд катионов за счёт освободившихся от анионов электронов. В результате связь катиона с анионными узлами постепенно ослабевает. Вследствие развитого теплового движения ионов может происходить отрыв фрагментов решётки, соответствующих по соотношению катионов и анионов составу низших оксидов (см. рис. 4, в). В этом случае наблюдается сублимация низших оксидов разного состава, характерная для оксидов алюминия, кремния, хрома, ванадия, молибдена и других многовалентных металлов [62, 63]. В частности, путём конденсации возгонов в восстановительных условиях нам удалось получить, разделить и детально исследовать кристаллы индивидуальных оксидов состава Al2O(3-x), Al3O4, AlO и Al2O, образованные катионами алюминия всех возможных для них зарядов от 1 до 3 (рис. 6).

| Рис. 6. Кристаллические возгоны – продукты восстановительной сублимации глинозёма: а – окрашенные кристаллы нестехиометрического глинозёма Al2O(3 – x), б – прозрачные идиоморфные кристаллы шпинели Al3O4, в – нитевидные кристаллы монооксида AlO, г– игольчатые прозрачные кристаллы Al2O. |
Восстановление активных металлов. Как уже отмечалось, твёрдый углерод в виде кокса широко используется в качестве восстановителя не только железа при производстве чугуна, но и более активных металлов – хрома, марганца, кремния и других при производстве ферросплавов. Восстановительная способность монооксида углерода часто недостаточна для восстановления таких металлов, поэтому в этом случае решающую роль отводят так называемому сажистому углероду, который образуется по реакции Будуара 2СО = Садс + СО2 или по реакциям диссоциации углеводородов типа СН2 = Садс + Н2. Считается, что образующиеся таким образом атомы твёрдого углерода адсорбируются поверхностью оксида и вступают в реакцию с молекулами оксида согласно рассмотренным выше представлениям адсорбционно-автокаталитической теории [16-19, 64-67]. Хотя в производственных условиях восстановления сажистым углеродом никто не наблюдал, возможность такой интерпретации не исключается, поскольку в газовой фазе печей присутствуют и монооксид углерода и углеводороды.
Получить убедительные доказательства восстановления активных металлов именно твёрдым углеродом позволили специально поставленные лабораторные эксперименты. В вертикальную трубчатую печь с графитовым нагревателем, изготовленным из графитированных электродов дуговых сталеплавильных печей, одновременно помещали два корундовых тигля с концентратом кемпирсайской хромовой руды. В одном тигле руду смешивали с раздробленным материалом графитового нагревателя, в другом находился только концентрат руды. Печь накрывали крышкой, нагревали до температуры 1200...1400ºС и выдерживали в течение 1...4 часов.

| 
| 
|
| Рис. 7. Преобразования в рудном концентрате (а) в атмосфере СО (б) и смеси с твёрдым углеродом (в): 1 – зёрна хромита, 2 – цементирующая фаза, 3 – конгломераты карбидов и силицидов, 4 – остатки хромита в виде безуглеродистого феррохрома внутри шпинельного остатка MgO–MgAl2O4, 5 – частицы графита в карбидной оболочке |
Использование в качестве материала нагревателя и восстановителя графита графитированных электродов исключало возможность выделения из них каких-либо летучих углеводородов, поскольку при получении кокса, обжиге и графитизации электродов материал подвергался длительной (сотни часов) высокотемпературной (до 3000ºС) обработке. Поскольку в закрытой печи с графитовым нагревателем весь кислород связан в монооксид углерода, то рудный концентрат в обоих тиглях находился под воздействием атмосферы СО, а в одном, кроме того, ещё и в контакте с твёрдым углеродом. Результаты эксперимента при температуре 1400ºС и выдержке 1 час приведены на рис. 7.
Видно, что в атмосфере СО появились отдельные металлические частицы железа в цементирующей хромиты силикатной фазе, а в хромитах никаких изменений не произошло. В смеси концентрата и графита железо и хром восстановились полностью, причём на поверхности частиц концентрата образовался сплав из карбидов с примесью силицидов железа и хрома, а внутри частиц – сплав безуглеродистого феррохрома.

| 
| 
|
| Рис. 8. Образование и разрушение карбидных оболочек на поверхности частиц углерода (а), рудного концентрата (б) и полное восстановление металлов внутри шпинельного остатка MgO–MgAl2O4 после разрушения оболочки (в). |
Эти и ранее проведённые аналогичные эксперименты [68-70] показали также, что на начальном этапе восстановления в слое смеси твёрдого углерода и рудного концентрата на поверхности частиц образуется карбидная оболочка. На частицах восстановителя она образована высшим карбидом Ме3С, а на поверхности частиц концентрата – смесью карбидов и силицидов. Образование этих оболочек замедляет и, в конечном счете, останавливает процесс восстановления. Восстановление продолжается и полностью завершается в случае оплавления и разрушения оболочек (рис. 8).
Результаты этих экспериментов однозначно свидетельствуют о том, что монооксид углерода восстанавливал железо только в цементирующей силикатной фазе, а хром и железо хромита восстановлены именно твёрдым углеродом. Образование карбидных оболочек на твёрдых реагентах свидетельствует о встречном переносе не только материала оксидов на поверхность углерода, но и углерода на поверхность оксида. Взаимный встречный перенос ещё можно было бы объяснить контактом твёрдых реагентов, но контакт не мог привести к образованию оболочек, в точности повторяющих рельеф поверхности частиц. Равнодоступность всей поверхности частиц для встречных потоков вещества могла быть обеспечена только массопереносом через газовую фазу, который реализуется в смеси реагентов. Следовательно, в слое смеси осуществляется бесконтактное взаимодействие твёрдых реагентов, результатом которого является химическая реакция между восстановителем и оксидом, образование заряженных анионных вакансий в оксиде, их распространение в объёме оксидной фазы, восстановление и выделение металлов в объёме оксидной фазы.
Для протекания всех этих процессов контакт твёрдых реагентов не обязателен, если учесть условия в тонком газовом промежутке между ними, прежде всего температуру. При температуре более 1000ºС у поверхности твёрдых фаз формируется низкотемпературная плазма, состоящая из электронов, ионов, молекул и их ассоциаций. Видимым проявлением существования плазмы является свечение поверхности нагретых тел, возникающее вследствие ремиссии электронов.
 Начальным импульсом к образованию плазмы в слое служит термоэлектронная эмиссия электронов с поверхности углерода, количественно описываемая формулой Ричардсона–Дэшмэна I 0 = A T2 exp(– Ф /k T), где А – коэффициент, зависящий от состояния поверхности, Ф – работа выхода электрона, k – константа Больцмана [71-75]. Термоэлектронная эмиссия происходит с поверхности любого нагретого тела, но в данном случае преобладает эмиссия с поверхности восстановителя, так как именно его внешние электроны слабее связаны с атомным ядром. Результатом эмиссии является появление электронного газа у поверхности твёрдого углерода. Эмиттированные электроны восстановителя притягиваются более электроположительными катионами металлов и связываются катионами оксидной фазы, заменяя менее прочные связи катион–анион в оксиде и облегчая удаление аниона кислорода из решётки оксида по реакции [C2+, 2ē]гр + (Fe2+, O2–)окс = COгаз + (Fe2+, 2ē, Va)окс . При малой ширине газового промежутка между ионами твёрдых реагентов кулоновское взаимодействие способствует отрыву от поверхности оксида и восстановителя не только отдельных ионов, но и фрагментов кристаллических решёток с не полностью скомпенсированными зарядами (см. рис. 4, в и 9).
Начальным импульсом к образованию плазмы в слое служит термоэлектронная эмиссия электронов с поверхности углерода, количественно описываемая формулой Ричардсона–Дэшмэна I 0 = A T2 exp(– Ф /k T), где А – коэффициент, зависящий от состояния поверхности, Ф – работа выхода электрона, k – константа Больцмана [71-75]. Термоэлектронная эмиссия происходит с поверхности любого нагретого тела, но в данном случае преобладает эмиссия с поверхности восстановителя, так как именно его внешние электроны слабее связаны с атомным ядром. Результатом эмиссии является появление электронного газа у поверхности твёрдого углерода. Эмиттированные электроны восстановителя притягиваются более электроположительными катионами металлов и связываются катионами оксидной фазы, заменяя менее прочные связи катион–анион в оксиде и облегчая удаление аниона кислорода из решётки оксида по реакции [C2+, 2ē]гр + (Fe2+, O2–)окс = COгаз + (Fe2+, 2ē, Va)окс . При малой ширине газового промежутка между ионами твёрдых реагентов кулоновское взаимодействие способствует отрыву от поверхности оксида и восстановителя не только отдельных ионов, но и фрагментов кристаллических решёток с не полностью скомпенсированными зарядами (см. рис. 4, в и 9).
П