Тема: Гравиметрический (весовой) метод анализа (часть 2)
Расчеты в гравиметрическом методе анализа
·.1. Расчёт массы навески.
Расчёт выполняется по 3-м методам гравиметрических определений.
-Метод выделения - анализируемую составную часть количественно (без потерь) выделяют (сжиганием, фильтрованием, электролизом) и взвешивают
Пример: определение содержания золы в топливе, пыли в воздухе, взвесей в промышленных водах
- Метод отгонки - анализируемую составную часть количественно удаляют из пробы и о ее содержании судят по убыли массы навески пробы.
Пример: определение влаги, летучих компонентов, потерь при прокаливании (ППП)
- Метод осаждения - анализируемую составную часть количественно связывают с помощью реагентов в осадок, в виде которого отделяют от других компонентов пробы и после ряда операций взвешивают.
Пример:
-определение серы SO42- + Ba2+ = BaSO4
-определение хлоридов Cl- + Ag+ = AgCl
-определение кальция Ca2+ + C2O42- = CaC2O4
Способ расчёта массы навески зависит от метода, к которому относится выполняемый анализ
Масса навески для метода выделения и отгонки должна быть такой, чтобы масса выделенной или удаленной из навески части составляла 0,1г.
В методе осаждения масса навески определяется природой осадка
Навеска должна быть такой, чтобы из нее образовались следующие массы осаждаемой формы
Таблица 1
| Вид осадка | Масса осаждаемой формы, г |
| Аморфный лёгкий (гидроксиды Al(OH)3,Fe(OH)3) | 0.1 |
| Кристаллический легкий (осадки легких металлов) CaC2O4,Mg2P2O7,BaCrO4 | 0.2 |
| Кристаллический тяжёлый (осадки тяжелых металлов) ВаS04, АgСl, Рb304 | 0.5 |
Для расчета необходимо знать примерное содержание анализируемого компонента или точную химическую формулу вещества анализируемой пробы
Пример 1.
Рассчитать массу навески каменного угля для определения его зольности, если предполагаема зольность 10%.
Дано:
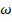 %золы
%золы  10%,
10%,
m золы = 0.1 г
m н =?
Решение
Масса золы в навеске должна быть 0.1г и от массы навески составлять 10%,следоватепьно вся навеска -100%
: 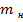 . =
. =  =
= 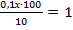 г
г
Ответ: масса навески равна 1г.
Пример 2.
Рассчитать массу навески образца кристаллической соды (Na2СОз*10Н2О)
для определения содержания кристаллизационной воды
Дано: mН20= 0.1г
, 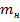 Nа2СОз * 10Н20?
Nа2СОз * 10Н20?
Решение:
М Na2СОз*10Н2О= 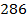 г/моль
г/моль
МН2О = 18г/моль
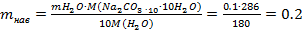 г
г
Ответ: масса навески 0,2г.
Пример 3.
Рассчитать массу навески кристаллического хлорида магния МgСl2*6Н20 для определения содержания хлора осаждением нитратом серебра Аg N0з в виде осаждаемой формы АgСl
Дано: m АgСl = 0,5г ( Таблица 1)
mн(МgСl2* 6Н20)?
Решение:
М МgСl2* 6Н20=  г/моль
г/моль
М АgСl =143 г/моль
 г 2*143г
г 2*143г
МgСl2* 6Н20+2АgN0з=2АgСl  +Мg(NO3)2 +6Н20
+Мg(NO3)2 +6Н20
Х 0.5г
mн = 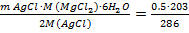 =0.35г.
=0.35г.
Ответ: масса навески 0,35г.
Пример 4.
Рассчитать массу навески сплава алюминия для определения содержания алюминия осаждением в виде гидроксида.
Предполагаемая доля алюминия в сплаве 20%.
Дано:
 Аl = 20%,
Аl = 20%,
m Аl(ОН)з = 0,1 г( Таблица 1)
mн?
Решение:
М Аl=27г/моль
М Al(OH)3=78 г/моль
27г 78г
Аl3+ +ЗNН4ОН = Аl(ОН) з + ЗNH4+
х 0.1г
2Al(OH)3 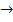 Аl2О3 + 3H2O
Аl2О3 + 3H2O
1. Рассчитаем массу алюминия из которой можно получить 0,1г.
 . =
. =  = 0.035г.
= 0.035г.
2. Рассчитаем массу навески сплава, из которой можем получить 0,035г Al
Масса алюминия от навески составляет 20% следовательно вся навеска -100%
mн = 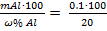 = 0.2г.
= 0.2г.
Ответ: масса навески 0,2г.
· 2.Расчет объема осадителя:
-по химическому уравнению рассчитываем массу вещества осадителя
-рассчитываем объем раствора осадителя с применением формул концентрации растворов (смотри 5 способов выражения концентраций)
Пример 1.
Рассчитать объем 15% раствора гидроксида аммония ( для осаждения железа из навески технического хлорида железа (III) массой 0.5235г
для осаждения железа из навески технического хлорида железа (III) массой 0.5235г
Дано:
 NH4OH = 15%,
NH4OH = 15%,
P=0.943 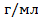
mн FeCl3 = 0.5235 г
V(р-ра)?
Решение:
М FeCl3 =162.5г/моль
М NH4OH =35 г/моль
Находим массу NH4OH по уравнению
162.5г 3*35
FeCl3 + 3 NH4OH = Fe (OH)3 + 3 NH4Cl
0.5235 х
Х=  = 0.338г
= 0.338г
По формуле массовой концентрации находим массу раствора
 NH4OH =
NH4OH = 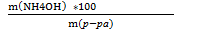
m (р-ра) = 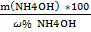 =
= 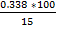 = 2.25г
= 2.25г
находим объем раствора
V(р-ра) = 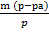 =
= 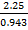 = 2.4мл
= 2.4мл
Осадитель летучий, поэтому с учетом избытка 100% объем осадителя равен 4.8 мл
Ответ: V(р-ра) = 4.8 мл
Пример 2.
Рассчитать объем 0.5н раствора серной кислоты для полного осаждения ионов стронция из массы навески 0.5265г технического хлорида стронция SrCl2*2H2O
Дано:
mн SrCl2*2H2O = 0.5265 г
C(1/2 H2SO4) =0.5 мол/л
V(р-ра)?
Решение:
М SrCl2*2H2O=195г/моль
М H2SO4 =98 г/моль
Находим массу H2SO4 по уравнению
195г 98 г
SrCl2*2H2O + H2SO4 = SrSO4 + 2 HCl + 2H2O
0.5265 г х
Х= 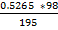 =0.265г
=0.265г
По формуле молярной концентрации эквивалента находим объем раствора
C(1/2 H2SO4) = 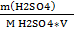 ; V =
; V = 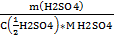 =
= 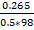 =0.0054л (5.4мл)
=0.0054л (5.4мл)
Осадитель нелетучий, поэтому с учетом избытка 50% объем осадителя равен 8.1 мл
Ответ: V(р-ра) = 8.1 мл
· 3. Расчёт результатов весовых определений.
Расчёты по методу выделения и отгонки типам определений сводятся к вычислению массовой доли определяемой составной части по отношению к массе навески.
Метод выделения:
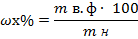
где: 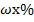 - массовая доля выделяемой составной части, %
- массовая доля выделяемой составной части, %
m в.ф - масса весовой формы (выделяемой составной части), г
m н - масса навески, г
ω  % =
% = 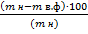
где:
ω  % - массовая доля влаги (летучих),%
% - массовая доля влаги (летучих),%
m в.ф - масса остатка после высушивания, г
m н - масса навески, г
Пример 1.
Для определения зольности каменного угля взята масса навески 0,9214г. После прокаливания до постоянного веса масса остатка (золы) составила 0,1032г. Рассчитать массовую золы в каменном угле.
Дано:
m в.ф (золы) = 0,1032г;
m н = 0,9214г;
ω% золы -?
Решение:
ω% золы = 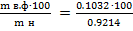 = 11,2%
= 11,2%
Ответ: массовая доля золы 11,2%.
Пример 2.
Масса навески технического хлорида натрия 2,0828г. после высушивания до постоянного веса составила 1,9918г. Определить массовую долю влаги в образце.
Дано:
m н = 2,0828г;
m в.ф = 1,9918г
ωвлаги -?
Решение:
ωвлаги 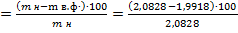 =4,37%
=4,37%
Ответ: массовая доля влаги 4,37%.
. Расчёты по методу осаждения сводятся к вычислению:
- массы определяемой составной части в навеске
- массовой доли массы определяемой составной части по отношению
к массе навески.
Определение массы составной части ведут исходя из пропорции:
М(f’экв. х) опр. части —---------------М(f’экв.х)вес.формы
m опр. части -------------------------------m вес. формы
m опр. части = 
где
m опр.части - масса определяемой части, г
М(f экв.(х)X) опр. части - молярная масса эквивалента определяемой части, г/моль
М(f экв.(х)) вес.формы - молярная масса эквивалента весовой формы, г/моль.
 величина постоянная и называется аналитическим фактором (множителем).
величина постоянная и называется аналитическим фактором (множителем).
Аналитическим фактором (F) называется отношение молярной массы эквивалента определяемой составной части к молярной массе эквивалента весовой формы. F 
Вычисляя аналитический фактор обычно берут отношение масс соответствующих количеств молекул (атомов) определяемой составной части и её весовой формы.
Значение аналитических факторов занесены в справочные таблицы
Пример 1.
F Ba/BaSO4 = 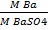 =
=  =0.5884
=0.5884
F Al/Al2O3 = 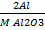 =
=  = 0.5293
= 0.5293
F Fe/Fe2O3 = 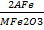 =
= 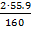 = 0.6994
= 0.6994
В соответствии с формулами получаем:
m опр.части = m вес.формы * F
О пределяя массовую долю массы анализируемой составной части по отношению к массе навески получаем формулу расчёта результатов весовых определений по методу осаждения:
ω%x = 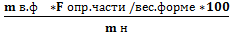
где:.
ω%x –массовая доля определяемого компонента, %
F 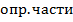 /вес.форме- аналитический фактор определяемой части по весовой форме
/вес.форме- аналитический фактор определяемой части по весовой форме
m нав. - масса навески, г
Пример 1.
Из массы навески технического кристаллогидрата хлорида бария ВаСl2 * 2H2O 0,5010г получен осадок ВаSO4 массой 0,4826г
Рассчитать массовую долю Ва в образце.
Дано:
mн= 0,5010г;
mв.ф ВаSО4=0.4826г
ω% Ва -?
Решение:
ВаСl2 + Н2SO4 = ВаSO4↓ + 2НСl
F Ва/ВаSO4 = 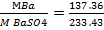 = 0.5884
= 0.5884
ω% Ва =  =
=  = 53,9%
= 53,9%
Ответ: массовая доля бария ω% Ва = 53,9%.
Пример 2.
Из массы навески 0,2017г сплава железа получен осадок оксида железа Fе20з массой 0,0871г. Определить массовую долю железа в сплаве.
Дано:
mн = 0,2017г;
mв.ф Fе2Оз = 0,0871 г
ω% Fе -?
Решение:
FеСlз + ЗNН4 ОН = Fе(0Н)з + 3NН4Сl.
2Fе(0Н)з → Fе20з + ЗН20
F Fе/Fе20з 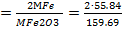 =0.6994
=0.6994
ω% Fе 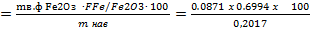 = 30,45%
= 30,45%
Ответ: массовая доля железа в сплаве ω% Fе = 30,45%.