Данные реакции также как и предыдущие являются реакциями нуклеофильного присоединения.
1. Взаимодействие с пентахлоридом фосфора
В результате реакции альдегиды и кетоны обменивают атом кислорода карбонильной группы на два атома хлора, при этом образуются дигалогенпроизводные, в которых оба атома галогена находятся при одном углеродном атоме, что используется для получения геминальных дихлоралканов.
R-CH=O + PCl5 -----® R-CHCl2 + POCl3
R-C=O + PCl5 -----® R-CCl2 + POCl3
½ ½
R R
2. Действие аммиака
Альдегиды реагируют с аммиаком образуя альдимины (содержат иминогруппу =NH), которые затем в результате тримеризации могут превращаться в альдегидаммиаки, имеющие циклическое строение.
Кетоны с аммиаком подобных соединений не образуют. Они реагируют очень медленно и претерпевают другие сложные превращения.
R-CH=O + H2NH -------® R-CH=NH + H2O
альдимин
3. Реакция с гидроксиламином
Альдегиды и кетоны реагируют с гидроксиламином образуя оксимы альдегидов (альдоксимы) и оксимы кетонов (кетоксимы) которые содержат в своей структуре гидроксииминогруппу =N-OH.
В реакции применяется солянокислый гидроксиламин (NH2OH·HCl), и выделяющаяся соляная кислота может быть оттитрована, что используется для количественного определения альдегидов и кетонов.
R-CH=O + H2N-OH ------® R-CH=N-OH + H2O
альдоксим
R-C=O + H2N-OH ------® R-C=N-OH + H2O
½ ½
R R
кетоксим
Реакции с участием радикалов связанных с карбонилом
Альдегиды и кетоны вступают в реакции не только при участии их карбонильной группы, но и за счет связанных с ней углеводородных радикалов. Карбонильная группа оказывает определенное влияние на течение этих реакций, что связано с вызываемыми этой группой электронными смещениями.
1. Реакции окисления
Альдегиды и кетоны различно относятся к действию окислителей.
Окисление альдегидов протекает очень легко даже при действии слабых окислителей, при этом образуются кислоты с тем же числом атомов углерода, что и у окисляемого альдегида.
Окисление кетонов проходит с трудом даже при взаимодействии с сильными окислителями при нагревании, сопровождается разрывом углеродной цепочки по обеим сторонам карбонильной группы и образованием смеси из четырех карбоновых кислот (правило Вагнера и Попова), каждая из которых содержит меньшее число атомов углерода по сравнению с исходным кетоном.

2. Галогенирование
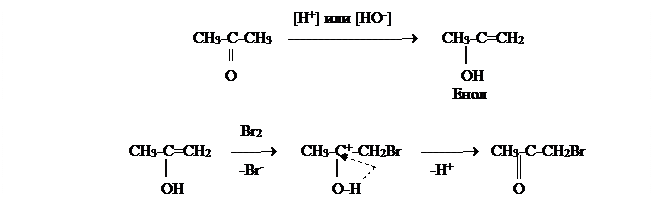
Водородные атомы в радикалах альдегидов и кетонов могут замещаться на галоген, при этом в первую очередь галоген замещает подвижные атомы водорода в a-положении к карбонильной группе.
Это объяснется тем, что наличие у карбонильного углерода частичного положительного заряда (d+), возникающего вследствие смещения p-электронов двойной связи к кислороду, вызывает электронные смещения в s-связях H-C при a-углеродном атоме, соответственно увеличивается поляризация этих связей и способность a-водородных атомов отрываться в виде протона.
Альдегиды и кетоны реагируют с бромом и йодом с одинаковой скоростью независимо от концентрации галогена. Замещение у них идет легче, чем в предельных углеводородах. Реакции ускоряются как кислотами, так и основаниями. Подробное изучение этих реакций привело к выводу, что они идут с предварительным превращением карбонильного соединения в енол.
Межмолекулярные реакции
Для соединений с карбонильной группой, особенно для альдегидов, характерны межмолекулярные реакции, при которых происходит взаимодействие (уплотнение) нескольких (конденсация) или многих (полимеризация) молекул с образованием продуктов, обладающих более сложной структурой и большей молекулярной массой.
1. Альдольная и кротоновая конденсация
Альдегиды в слабоосновной среде (под влиянием разбавленных щелочей; в присутствии ацетата, карбоната или сульфита калия) подвергаются альдольной конденсации с образованием альдегидоспиртов (оксиальдегидов), сокращенно называемых альдолями.
Альдольная конденсация кетонов происходит в более жестких условиях – в присутствии оснований (например, гидроксид бария).
Возможна конденсация и между альдегидами и кетонами.
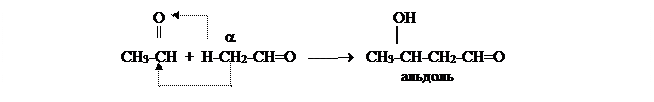
Следует обратить внимание на то, что в реакцию вступает только группа, находящаяся в a-положении к карбонилу, так как водородные атомы только этой группы в достаточной степени активируются карбонильной группой.
Если рядом с карбонилом находится четвертичный атом углерода, альдолизация невозможна.
При нагревании (без водоотнимающих веществ) альдоль отщепляет воду с образованием непредельного кротонового альдегида. Поэтому переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией.

При действии на альдегиды, способные к альдольной конденсации, сильных оснований (щелочей) в результате глубокой альдольной (или) кротоновой поликонденсации происходит осмоление.
Альдегиды, не способные к альдольной конденсации, в этих условиях вступают в реакцию Канниццаро.
2 (CH3)3C-CHO + KOH ---------® (CH3)3C-COOK + (CH3)3C-CH2OH
2. Сложноэфирная конденсация
Эта конденсация (реакция Тищенко) присуща только альдегидам, она проходит при действии на альдегиды алкоголятов алюминия в неводной среде. В результате реакции конденсации одна молекула альдегида присоединяется к карбонильной группе второй молекулы альдегида и образуется сложный эфир (поэтому реакции такого типа и называются сложноэфирной конденсацией).

Альдегиды могут вступать в реакцию конденсации и с соединениями других классов (например, с фенолами, ароматическими аминами и др.).