Тема: Константа растворимости (Произведение растворимости)
План
1. Гетерогенные системы
2. Константа растворимости
3. Взаимосвязь между растворимостью и константой растворимости
4. Условия образования осадков
Гетерогенными называются такие системы, которые состоят из нескольких фаз и имеют реальную физическую границу раздела.
Фаза – это часть системы с одинаковыми химическими и физическими свойствами. Межфазные процессы заканчиваются восстановлением гетерогенных динамических равновесий. Например, минеральные компоненты костной и зубной ткани находятся в равновесии с ионами кальция и фосфата плазмы крови. Смещение этого равновесия может привести к развитию патологических состояний. При некоторых патологических состояниях может начаться образование твердой фазы. Например, возникновение мочевых камней (оксалат кальция, фосфат кальция, мочевая кислота) при почечнокаменной болезни, образование холестериновых камней и т.д. В аналитической химии существует ряд гетерогенных процессоров, которые сопровождаются выпадением или растворением осадков. Знание общих закономерностей установления и смещение гетерогенного равновесия позволяет управлять процессами разделения, растворения и определения веществ.
В растворах твердых электролитов (чаще всего это основания и соли) имеет место равновесие на границе двух фаз, например: AgCl(тв) = Ag+ + Cl–.
Оба процесса – прямой и обратный – происходят очень быстро: достаточно в раствор с осадком AgCl добавить иодид калия и перемешать смесь, как почти сразу же весь белый хлорид серебра переходит в желтый иодид AgI; если же в раствор добавить бесцветный сульфид натрия, немедленно образуется черный сульфид серебра Ag2S.
Константа растворимости
Рассмотрим процессы, возникающие при взаимодействии малорастворимого, но сильного электролита ВаSO4 с водой. Под действием диполей воды ионы Ва2+ и SO42- из кристаллической решетки будут переходить в жидкую фазу. Одновременно под влиянием электростатического поля кристаллической решетки часть ионов Ва2+и SO42- будет осаждаться. При данной температуре в гетерогенной системе установится равновесие: скорость процесса растворения (v1) будет равна скорости процесса осаждения (v2).
ВаSO4 ↔ Ва2++ SO42-
Тв.фаза. Раствор
Такой раствор называется насыщенным. Равновесная гетерогенная система характеризуется константой химического равновесия:
Кх.р.= 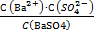 ,
,
Знаменатель этой дроби является постоянной величиной, поэтому произведение
К х.р.∙ С(ВаSO4 ) – величина постоянная(произведение растворимости или константа растворимости). Обозначается ПР или Кs. Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражении Кs (ПР) концентрации ионов берутся в соответствующих степенях, равных стехиометрическим коэффициентам.
PbСl2 ↔ Pb2+ +2Cl -; Ks =C(Pb2+) ∙ C2(Cl-)= ПР (PbCI2)
Ag2CrO4 ↔ 2Ag++ CrO42- Ks =C2 (Ag+) ∙ C(CrO42-)= ПР(Ag2CrO4)
Произведение растворимости (константа растворимости) – это произведение молярной концентрации ионов малорастворимого электролита в его насыщенном растворе. Каждая из концентраций берется в степени, равной количеству ионов, образующихся при диссоциации данного электролита.
В общем виде для электролита АmBn константа растворимости рассчитывается по формуле: Ks (АmBn) = Сm(А) ∙ Сn(В).
Величиной Ks принято пользоваться только в отношении электролитов, растворимость которых в воде не превышает 0,01моль/л.
Так как абсолютно нерастворимых веществ нет, то и Ks  0
0
Взаимосвязь между растворимостью и константой растворимости
Количественно растворимость различных веществ выражается концентрацией насыщенных растворов. Растворимость данного вещества равна его молярной концентрации в насыщенном растворе (Sмоль/л). Растворимость часто выражается в граммах растворенного вещества на 100г или на 1000г растворителя. Связь между Кs и растворимостью зависит от числа ионов, на которые распадается малорастворимый сильный электролит в растворе.
Бинарный электролит:
АgСI (т) ↔ Аg+ (р)+СI- (р); Кs (АgСI)=С(Аg+) ∙ С(СI-) = 1,8 ∙ 10-10.
При равновесии: С(Аg+) = С(СI-) = S(АgСI);
Кs (АgСI)=S2 (АgСI); S (АgСI)=  =
=  =1,3 10-5
=1,3 10-5
Трёхионный электролит:
Ag2CrO4 (т.) ↔ 2Ag+(р.) + CrO42-(р.); Ks (Ag2CrO4)=C2 (Ag+) ∙ C(CrO42-)=1,1∙ 10-12.
В состоянии равновесия: C(CrO42-)= S(Ag2CrO4 ) и С(Аg +) =2S(Ag2CrO4)
Ks (Ag2CrO4)=(2S)2 ∙ S =4S3 (Ag2CrO4),
S(Ag2CrO4 ) =  =
=  =6,5 10 -5 моль/л.
=6,5 10 -5 моль/л.
В общем виде S(АmВn)= 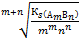 .
.
По величине Ks ряда однотипных соединений (индексы m и n у них одинаковые) можно судить об их относительной растворимости: чем меньше Ks, тем меньше растворимость. Например, можно сравнивать растворимость (в единицах моль/л) для FeS и CuS, но нельзя сравнивать значения Ks для CuS и Ag2S (разные m). Значения Ks для некоторых малорастворимых соединений приведены в таблице.