Для проведения нашего исследования мы решили воспользоваться следующими методами:
| ! | Подумать самостоятельно | Как сделать так, чтобы дети с интересом изучали периодическую таблицу химических элементов. Как рассказать детям о химических элементах, чтобы это было и интересно и познавательно. |

| Посмотреть книги о том, что исследуешь | Узнать, как появилась периодическая таблица и как она устроена. |
| Спросить у других людей | Опросить взрослых и детей, что они знают о химических элементах. | |

| Обратиться к компьютеру, посмотреть в глобальной сети Интернет. | Найти информацию о периодической таблице и элементах, которые в ней содержатся. |

| Понаблюдать | Понаблюдать, будет ли нашим одноклассниками и другим детям интересно изучать детскую таблицу химических элементов. |

| Провести эксперименты | Попытаться с помощью несложных экспериментов понаблюдать за свойствами некоторых химических элементов. Визуализировать и нарисовать лица из таблицы. |
Группы элементов
 Давайте поближе познакомимся с группами химических элементов.
Давайте поближе познакомимся с группами химических элементов.

 Это интересно!
Это интересно!
√ Литий, натрий и калий легче воды и плавают на её поверхности.
√ Литий обладает живительными свойствами. Например, помогает лечить подагру.

 Это интересно!
Это интересно!
√ Бериллий не реагирует с кислородом при температуре ниже 600 градусов по Цельсию. Магний не окисляется до температуры +650 градусов. Калий окисляется при комнатной температуре в присутствии водяных паров и сгорает при небольшом нагревании, но в сухом воздухе он устойчив.
√ Стронций, барий и радий быстро окисляются на воздухе, поэтому их, как и щелочные металлы, хранят под слоем керосина. На Земле в свободном состоянии не встречаются из-за высокой химической активности.

 Это интересно!
Это интересно!
√ На 2014 год в мире добыто 179 тонн золота. Это очень мягкий металл, поэтому для изготовления ювелирной продукции его обычно сплавляют с медью или серебром.
√ Ртуть – единственный металл, который становится жидким при комнатной температуре. Её запрещено перевозить в самолётах, так как ртуть разъедает алюминий, а в самолетах много алюминиевых деталей.
√ Железо - самый популярный элемент группы. В глубокой древности, чтобы сделать железо прочнее, его обжигали в навозе и лоскутах кожи.
√ Серебро обладает благотворными, целебными, очистительными свойствами. В связи с этим, в старые времена была распространена серебряная посуда. А в современном мире на космической станции работают серебряные очистители.

 Это интересно!
Это интересно!
√ Наиболее прочный титан чаще всего применяется для производства синтетических пластиков, бумаги и красок.
√ Алюминий долго считался самым дорогим металлом и ценился выше золота и серебра.
√ Калифорний – самый дорогой синтезированный металл. Его стоимость превышает 6,5 миллионов за грамм.

 Это интересно!
Это интересно!
√ Водород неметалл по всем внешним признакам, а по своим химическим свойствам ведёт себя как металл.

 Это интересно!
Это интересно!
√ Группа галогенов единственная в таблице включает вещества в трёх агрегатных состояниях. При температуре 20 градусов и давлении 1 атмосфера, фтор и хлор являются газом, бром жидкостью, а йод - кристаллами.
√ Около 10 учёных погибли или нанесли вред своему здоровью в попытке выделить фтор в чистом виде.

 Это интересно!
Это интересно!
Благородные газы участвуют в реакциях только в экстремальных условиях.
Радон радиоактивен и имеет короткий срок распада, из-за чего изучение его свойств затруднено.
Гелий второй по распространённости элемент во Вселенной после водорода, однако, на Земле его достаточно мало, так как он улетучился в космос во время образования планеты.
Благородные газы химически не токсичны, однако могут воздействовать на организм человека как наркотик.
Вот как выглядят благородные газы в вакуумных стеклянных колбах, через которые пропущен ток:

Друзья или враги?
Мы познакомились с группами химических элементов. Их так много! Но какие же элементы мы встречаем чаще всего в своей обычной жизни? Оглянемся вокруг. Вот, например, соль. Без неё сложно обойтись в хозяйстве, но так ли она полезна? Химическая формула соли NaCl. Активный щелочной металл натрий отлично уживается в этом соединении с активным галогеном хлором. Но безопасен ли хлор? Ведь мы знаем, что он может быть очень опасным. Давайте разберёмся, какой же он на самом деле.
Хлор – химический элемент группы галогенов, сильный окислитель. В чистом виде это светло-зелёный ядовитый газ с резким запахом. Из хлора получается соляная кислота – одна их основных кислот в химических лабораториях. Эта кислота очень опасна! Также из соединений хлора получается много других опасных веществ, которые относят к отравляющим веществам. Некоторые соединения хлора даже используют для производства химического оружия! Получаются осень страшные вещества, ведь во время войн от них без единого выстрела могли погибнуть тысячи людей! Однако и пользы от хлора много. Самое популярное его соединение – это поваренная соль. Слабый её раствор содержится в организме человека. Ежедневно в наш организм должно поступать от 4 до 6 граммов хлора! А во время активных физических нагрузок и в сильную жару эта норма может увеличиться! Если в организме не хватает хлора, человек может почувствовать вялость, сонливость, вялость, сухость во рту, слабость в мышцах. Можно даже перестать чувствовать вкус пищи и потерять аппетит. Хлор в организме человека:
· регулирует водный и кислотно-щелочной баланс,
· выводит жидкость и соли из организма в процессе осморегуляции,
· стимулирует нормальное пищеварение,
· нормализует состояние эритроцитов,
· очищает печень от жира.
В желудке человека даже есть чуточка соляной кислоты, ведь без неё не получится переварить пищу! Получить этот элемент мы можем с пищей, которую едим. Это яйца, морепродукты, мясо, горох, фасоль, чечевица, рис, гречка, оливки.
Таким образом, хлор не только опасен, но и полезен. Главное, быть с ним аккуратным! Рассмотрим в таблице, для чего же применяют хлор.
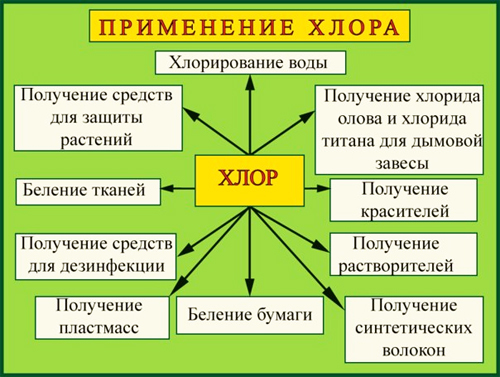
Что же ещё опасного может повстречаться нам на пути, что на первый взгляд очень полезно? Мы все пользуемся градусниками во время простуды. Серебристый столбик внутри него точно указывает, есть ли у нас температура. Он очень полезен, ведь помогает нам выздоравливать. Разберёмся же подробнее, что за элемент точно знает температуру тела человека. Наши мамы рассказали нам, что это ртуть, и мы снова окунулись в дополнительную литературу в поисках её описания.
Ртуть – единственный металл, который при комнатной температуре находится в жидком состоянии. Она замерзает при температуре всего -38,9 градусов. А при +356 градусах ртуть закипает и превращается в ядовитый пар. Ртуть – самая тяжёлая жидкость. Тяжёлые станки, стальные машины, чугунные гири и даже алюминиевые самолёты плавали бы в озере из ртути. Ранее ртуть часто применяли лекари для лечения кожных заболеваний, как мочегонный или слабительный препарат, добавляли её в зубные пломбы. Сейчас ртуть используют в сельском хозяйстве в качестве пестицида, потому что она убивает микробы. А ещё из-за этого свойства ртутной краской красят корабли, так как на подводной части судна образуется очень много бактерий и разных микроорганизмов, а ртуть помогает с ними бороться. Это защищает корпус корабля от разрушения. Ртуть нельзя перевозить на самолёте, но это не из-за того, что она токсичная. Просто ртуть очень активно взаимодействует с алюминием, делая его очень хрупким. А значит, если её случайно разлить, это может повредить самолёт. А ещё ртуть обнаружена в морской воде. Из-за этого она содержится и в рыбах. Причём в хищных рыбах концентрация ртути намного выше. Например, мясо дельфинов слишком токсично, поэтому его нельзя употреблять в пищу, как и мясо акул. Помните Безумного шляпника из «Алисы в Стране Чудес»? Многие шляпники в прежние времена часто страдали психическими расстройствами. Ведь фетр, из которого делали шляпки, обрабатывали парами ртути. Эти пары накапливались в организме шляпников, из-за чего те сходили с ума. Ртуть, хоть и полезна для человека, всё равно очень опасна! С ней нужно быть осторожными!

А есть ли безопасные, во всём полезные элементы в периодической таблице?
Под номером 8 здесь разместился наш друг, кислород. Вот он-то точно безопасен, ведь мы им дышим, без него невозможна жизнь на нашей планете!
Кислород - единственный газ, который поддерживает дыхание и горение. А ещё это самый активный окислитель. Его назвали рождающий кислоты, потому что считали, что он обязательно входит в состав кислот. Если кислород соединяется с водородо, получается ещё одно соединение, необходимое для жизни - вода. В воздухе, которым мы дышим, кислорода не так много, всего 21%, но это оптимально для дыхания. Если его будет меньше, человек начнёт задыхаться. Однако, чистым кислородом тоже дышать нельзя! Ведь он сильный окислитель и может обжечь лёгкие! Интересно то, что воздух, которым мы дышим состоит из молекулы, в которой два атома кислорода. Химическая формула его О2. А есть ещё одно вещество, состоящее только из кислорода. Это озон. У него в одной молекуле три атома (О3). Он образуется из двухатомного кислорода при ударе молнии. Озон - очень важный газ! Он задерживает ультра фиолетовые лечить, опасные для всего живого. Озона много в верхних слоях атмосферы, на высоте 20-25 км. Этот озоновый слой бережёт жизнь на нашей планете. Однако, хоть он и необходим на высоте, в нижнем слое атмосферы озон опасен для нас. Даже небольшое количество Озона может вызвать отравление, обжечь глаза и дыхательные пути! Озон опасен не только для людей, но и для микробов, поэтому его используют в медицине. Он помогает обеззараживать инструменты и помещения.. Представляешь, чистый озон синего цвета!
У кислорода есть ещё одно важное свойство. Вступая в реакцию с деревом или газом, он помогает им гореть. Это единственный газ, который поддерживает такую реакцию - горение. Если лишить пламя доступа к кислороду, огонь потухнет. Вот такой он, кислород. Жизненно необходим, но все равно немного опасен...
 Жидкий кислород
Жидкий кислород
Тогда давайте вернёмся к кальцию, с которого мы начинали разговор в нашей работе. Мы все знаем, что кальций нужен для того, чтобы наши кости были крепкими. А ещё мы знаем, что из него состоит мел, которым мы пишем. Есть ли и у него опасные свойства? И почему он металл? Кальций – самый известный строитель. Он может построить почти всё! Например, одно из соединений кальция - фосфат кальция– строительный материал для скелета людей и животных. Если кальция не будет хватать в организме, кости станут хрупкими и могут легко сломаться. Ещё одно из соединений кальция – карбонат кальция – это известняк, мел, мрамор, перламутр и даже жемчуг. Известняк – строительный материал, известный с древних времён. Из него построены Египетские пирамиды, Великая китайская стена, многие здания в Москве, из-за чего она называлась «белокаменной». Ещё два современных строительных материала – бетон и цемент. Они также состоят из кальция. В чистом виде кальций – довольно твёрдый, белый щелочноземельный металл. Он быстро окисляется на воздухе, а при небольшом нагревании горит ярко-красным пламенем. Этот элемент очень химически активен, а еще он обладает восстановительными и металлическими свойствами. Все эти характеристики делают кальций типичным представителем группы щелочноземельных металлов.

Кальций в атмосфере аргона
Делаем сложное простым!
Их так много и все такие разные, сложные, особенные. Как же их всех запомнить, да так, чтобы не зазубривать, а понять и полюбить? А может быть нам их всех… нарисовать? Вот титан – он очень сильный, он даже в космосе есть, из него строят корабли, ракеты. Вот благородный газ аргон – живет в лампочках накаливания и практически бесцветный, но такой весь важный и полезный. А вот и залог чистоты и убийца микробов – хлор. Чем-то он на известную ведущую Лену Летучую похож. Вряд ли ее, конечно, сам Дмитрий Иванович Менделеев знал, но мы знаем, а значит наш хлор будет именно такой – строгий, в белых перчатках и с пучком на голове. Но зеленовато-желтый – теперь мы это знаем, как и то, что хлор - газ, быстро растворяется в воде, и в жидком виде дает белый туман.
Если знать основные свойства каждого элемента, то понять его несложно, особенно если взять и зарисовать. Мы распределили элементы по группам и нарисовали каждый своих любимцев.
Картинки нам понравились, но в них все еще легко запутаться. Надо научиться с ними играть и заинтересовать других. К каждому персонажу из таблицы мы дадим описание в стихотворной форме, а теперь пора играть! Запоминайте правила!
Правила игры
Цель игры: набрать наибольшее количество фишек, запомнив максимальное количество фактов об элементе.
Количество игроков: 2-10
Подготовка к игре: Перемешайте карточки с элементами и раздайте игрокам по 5 карточек.
Процесс игры: Игроки в течение 10 минут изучают карточки с элементами и запоминают их свойства. Затем карточки переворачивают картинками вверх и сдают ведущему. Ведущий выбирает из стопки одну карту. Один из игроков называет все характеристики элемента, которые он запомнил. За каждую названную характеристику игрок получает фишку.
Определение победителя: Побеждает тот, у кого больше всего фишек.
Игрок, у которого к концу игра набрано от 1 до 5 фишек – Студент.
Игрок, у которого набрано от 6 до 10 – Лаборант.
Игрок, набравший от 11 до 15 – Химик.
Игрок, набравший от 15 до 20 – Профессор.
Игрок, набравший больше 20 фишек – Дмитрий Иванович Менделеев.
Примечание: Игру можно проводить несколько раундов подряд для изучения разных элементов.
Правила игры для дошкольников: Из стопки выбирается 5 карточек. Ведущий вслух зачитывает стихи про элементы. Затем он показывает одну из пяти карточек, а игроки должны по очереди вспомнить свойства этого элемента. Игрок, который не может вспомнить свойство, пропускает ход. За правильно названное свойство игрок получает фишку.
Игрок, у которого к концу игра набрано от 1 до 3 фишек – Лаборант.
Игрок, у которого набрано от 4 до 6 – Химик.
Игрок, набравший от 7 до 9 – Профессор.
Игрок, набравший больше 10 фишек – Дмитрий Иванович Менделеев.
Правила игры №2.
Цель игры: набрать наибольшее количество фишек, разложив все элементы по таблице.
Количество игроков: 2-5
Подготовка к игре: Разложите игровое поле. Перемешайте карточки с элементами и раздайте игрокам по 5 карточек. Остальные карточки остаются в стопке рядом с игровым полем.
Процесс игры: Каждый игрок в свой ход должен найти место в таблице для наибольшего числа своих карточек за 15 секунд. За каждый элемент, которому получилось найти место, игрок получает 1 фишку. После окончания хода игрок добирает из колоды карточки, чтобы их снова стало 5. Игра идёт до тех пор, пока все карточки не будут разложены в таблице.
Определение победителя: Побеждает тот, у кого больше всего фишек.
Правила игры №3.
Цель игры: быстрее остальных игроков составить пары из карточек.
Количество игроков: 2-8
Подготовка к игре: Потребуется 2 колоды карточек: одна с картинками, другая со стихами об элементах. Из обеих колод необходимо отложить несколько карточек так, чтобы оставшиеся делились между игроками поровну. Откладывать следует парные карточки (карточка с элементом и карточка с соответствующим стихотворением). Перемешайте карточки с элементами и раздайте игрокам по одинаковому числу карточек с картинками. Карточки игроки должны разложить картинкой вверх, не читая стихотворение на обороте.
Процесс игры: Ведущий вынимает из стопки карточку со свойствами и зачитывает стих игрокам. Игроки, слушая стих и рассматривая карточку, угадывают, о каком элементе идёт речь. Если игрок догадался, что у него картинка с этим элементом, он может забрать себе карточку со свойствами и накрыть свою картинку текстом.
Определение победителя: Побеждает тот, у кого быстрее всего картинки закроются стихами.
Выводы.
Итак, в ходе работы нам удалось решить все семь поставленных задач. Мы поняли, что таблица Менделеева или периодическая система химических элементов, – не просто ячейки, цифры и буквы, а систематизированные знания обо всем, что нас окружает. Таблица начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы — в правой части таблицы. Металлоиды расположены между ними. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Мы узнали, что каждый элемент обладает набором химических и физических свойств. Он вступает в реакции с другими веществами. Знания свойств каждого элемента помогают нам опасных реакций и создавать полезные.
Мы поняли, что такое химическая реакция. Самая простая, например, это горение. Если просто зажечь свечу – можно уже наблюдать химическую реакцию. Во время горения горючее (например, головка спички) соединяется с окислителем (например, кислородом) под действием тепла. Для начала процесса горения необходимы пламя или искра, с помощью которых горючее вещество поджигается. Затем выделяющееся в процесс горения тепло само поддерживает процесс. Свеча сделана из твердого парафина, состоящего из водорода и углерода. Фитиль тоже пропитан парафином. Пламя неравномерно: по его краям от контакта с кислородом воздуха происходит горение парафина и выделяется тепло. В самом центре пламени, где кислорода нет, парафин разлагается на углерод и водород. Углерод под действием тепла раскаляется, от него зависит яркость пламени. Произвольные продукты химической реакции горения – сажа и зола.
Мы разделили элементы на опасные и дружелюбные. Правда, даже нейтральные элементы могу вступать в химические реакции и превращаться в крайне опасных.
На основании интересных фактов и основных свойств мы выделили лица из таблицы, представив и изобразив элементы в виде забавных монстриков. Так, на наш взгляд, их гораздо легче понять и запомнить.
Из своих рисунков мы создали игру для детей дошкольного или младшего школьного возраста по легкому запоминанию таблицы Менделеева и безопасному взаимодействию с химическими веществами.
Мы выяснили с какими химическими веществами мы встречаемся в своей повседневной жизни, и что среди них есть немало опасных.
Изучив все материалы, проделав опыты и творческую работу мы надеемся, что смогли помочь сделать этот мир более понятным и предсказуемым для детей, которые еще не изучали химию. А значит, наша цель достигнута.
Мы подтвердили наши гипотезы на собственном примере доказав, что в периодической таблице Д.И. Менделеева могут разобраться даже школьники и дошкольники, стоит только творчески подойти к процессу изучения. Ведь если сделать периодическую таблицу интересной, даже дети заинтересуются химией.
Завершив наши исследования и эксперименты, мы пришли к следующим выводам:
1. Весь мир состоит из разных элементов, которые уместились в одной разноцветной таблице.
2. Свое название таблица получила не зря. Дмитрий Иванович Менделеев существенно облегчил нам задачу по изучению химии, систематизировав все элементы по группам и свойствам. Нам остается только запомнить и применять.
3. Элементы умеют удивлять. Про каждый из них можно найти много интересно, а свойства некоторых и вовсе изучены не до конца.
4. Есть элементы опасные, есть полезные, есть редкие и есть очень распространенные, но все – важные, все – часть нашего мира.
5. Набор свойств каждого элемента легче запомнить, если этот элемент нарисовать.
6. Изучить таблицу Менделеева легче всего – сыграв в интересную игру. Мы ее придумали и предлагаем вам.
Результатом нашего исследования стала игра для тех, кому от 0 и до 99. Для того, чтобы погрузиться в мир химии, теперь необязательно ждать перехода в старшие классы. И наша игра уж точно не скучная, попробуйте!