Основные газы атмосферы (N2, O2, Ar) составляют 99.96% ее содержания.
Остальные газы, называемые малыми, определяют радиационную структуру и химическую активность атмосферы.
Главные малые газы: CO2 (0.03% или 300 ррм), H2O (водяной пар-от нескольких процентов до 5 ррм), O3 (до 10 ррм), CH4 (около 2 ррм), окислы азота (до 1 ррм).
Общее количество малых газов атмосферы, играющих ту или иную роль в атмосферных процессах, достигает 200 наименований.
Водяной пар — важнейшая составляющая атмосферы, которая определят ее тепловой, радиационный и динамический режим. Основной источник водяного пара в атмосфере — испарение. Другой важный источник — вулканизм.
 Основной механизм выведения водяного пара из атмосферы — конденсация и выпадение осадков. Помимо выведения водяного пара путем конденсации есть и другие стоки. Например, сток H2O из атмосферы осуществляется путем фотодиссоциации молекул при поглощении излучения с длиной волн менее 200 нм:
Основной механизм выведения водяного пара из атмосферы — конденсация и выпадение осадков. Помимо выведения водяного пара путем конденсации есть и другие стоки. Например, сток H2O из атмосферы осуществляется путем фотодиссоциации молекул при поглощении излучения с длиной волн менее 200 нм:
H2O + hv-» Н + ОН
и при взаимодействии с атомарным кислородом:
H2O + О-» 2ОН
Молекулярный водород - является стабильной молекулой. Время глобального цикла 2—3 года. Источники молекулярного водорода — океаны, вулканы, окисление метана, терпена, изопренов, сгорание биомассы, антропогенная деятельность (в особенности автотранспорт). Сток водорода осуществляется за счет фотохимических процессов. Также разрушение Н2 может происходить при взаимодействии с атомарным кислородом, в результате чего образуются радикалы Н и ОН:

Кроме водяного пара и молекулярного водорода важное участие химии атмосферы играют водородные радикалы. Они являются одними из самых активных реагентов в атмосфере. Наиболее распространенные среди них — это атомарный водород Н, гидроксил ОН, гидропероксид НО2.
Гидроксил ОН — один из самых важных с точки зрения химической активности представителей семейства водородных радикалов. Он практически не реагирует с основными составляющими атмосферы, такими, как N2, О2, СО2 или Н2О. Но  он активно вступает в реакции с малыми газовыми составляющими, концентрации которых в атмосфере ничтожны (диметилсульфид, сероводород, оксиды серы и азота, кислоты и др.).
он активно вступает в реакции с малыми газовыми составляющими, концентрации которых в атмосфере ничтожны (диметилсульфид, сероводород, оксиды серы и азота, кислоты и др.).
Основная масса ОН (около 42%) находится в слое на высотах 30— 50 км. Ниже 16 км (в тропосфере) содержится менее 90/0 от общей массы ОН. Выше 90 км — не более 1 % атмосферного ОН.
Гидроксил может образовываться при реакции молекулярного водорода и атомарного кислорода. Еще один из источников гидроксила — фотолиз озона под воздействием коротковолновой солнечной радиации (Х < 319 нм):

Азотные соединения. Среди множества азотных соединений в атмосфере помимо молекулярного азота N2 наиболее распространены аммиак NH3, оксиды азота (в основном NO и NO2 и азотная кислота HNO3).
Молекулярный азот начал поступать в атмосферу Земли уже на первых стадиях ее формирования в результате дегазации мантии до развития каких-либо форм жизни. В настоящее время дополнительным важным звеном в глобальном цикле азота стал обмен азота между биосферой и атмосферой. Полный цикл преобразований азота включает в себя два малых цикла. Один из них — это обмен азотом между атмосферой и биосферой в процессе усвоения азота растениями и денитрификации; другой цикл состоит из перехода органического азота в осадочные породы и его последующего возврата в биосферу.
Поступление азота из атмосферы в биосферу происходит благодаря симбиотической и несимбиотической фиксации его бактериями. После отмирания органическая масса подвергается разложению и минерализации, переходит в аммоний, который может частично усваиваться растениями, частично уходить в атмосферу. Некоторые бактерии способны переводить аммоний в нитриты и далее в нитраты. Этот процесс называется нитрификацией. Многие растения могут усваивать нитраты и аммоний и переводить их в процессе обмена веществ в органические азотные соединения (денитрификация). В процессе денитрификации NO3 переходят в газообразные NО, NO2, N2O и N2, которые могут возвращаться обратно в атмосферу.
Процесс денитрификации происходит в анаэробных (бескислородных) условиях и регулируется бактериями. N2 — конечный продукт денитрификации. Если в результате денитрификации азот возвращается в атмосферу в составе N2O, то он вновь становится недоступным для биосферы и выводится, таким образом, из биосферного цикла. Тем более, что затем он подвергается фотолизу под действием ультрафиолета, образуя N2, который не усваивается растениями напрямую. NO и NO2, напротив, не выводят азот из биосферного цикла, поскольку они могут окислиться в дальнейшем до HN03 и вернуться к поверхности с осадками или в процессе сухого и влажного осаждения.
Закись азота N20 была открыта в 1938 г. при изучении полос поглощения солнечного спектра. В течение последующих 30 лет N20 не привлекал большого внимания, поскольку не являлся слишком активным с химической точки зрения и не представлял опасности, как загрязнитель атмосферы. В стратосфере N20 подвергается фотолизу, а также взаимодействует с возбужденными атомами кислорода, образуя NO:
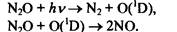
Продукт реакции (2 ур-е) NО негативно влияет на содержание озона в стратосфере, способствуя развитию каталитических циклов разрушения озона азотными соединениями. Поэтому N20 косвенно определяет изменения концентрации озона.
Диоксид азота NО2, а также NO N03, N203, N204, N205 очень активны с химической точки зрения. Окисление N02 в атмосфере ведет к образованию азотной кислоты и нитратов в составе аэрозолей, которые потом выпадают на подстилающую поверхность. Образование N205 происходит в ходе реакций:

Эти реакции идут в ночное время, так как днем N03 быстро разлагается фотолизом. Образовавшись ночью, N205 на свету разлагается в течение нескольких часов или суток, в зависимости от температуры и высоты:
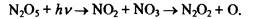
В тропосфере азотные соединения, особенно NOx, играют важную роль в многочисленных реакциях, происходящих в фотохимическом смоге. В частности, образование пероксиацетилнитратов (ПАН) при фотохимическом смоге приводит к гибели многих растений, а также раздражению слизистых оболочек. Основные источники NOx — сжигание ископаемого топлива, горение биомассы, эмиссия из почвы, молниевые разряды. Основной сток происходит путем влажного осаждения образовавшихся ионов NO3. При реакциях N02 с гидроксилом в атмосфере образуется азотная кислота:
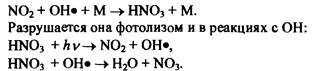
Азотная кислота хорошо растворима и выводится из атмосферы в основном с дождем и снегом, изменяя, таким образом, кислотность атмосферных осадков и почв на территории, где эти осадки выпадают. 
Таким образом, наличие в атмосфере МГС (малых газовых составляющих  водородных радикалов, оксидов азота, метана и др.) играет не меньшую роль в ее химии, чем присутствие основных компонентов (N2 и О2). Несмотря на чрезвычайно низкое содержание и, зачастую, короткое время существования МТС способны влиять на концентрации других веществ (О3, СН4 и др.), определяющих радиационно-тепловой режим системы Земля—атмосфера. Избыточные концентрации некоторых тропосферных МГС (НОх NOx и др.) являются продуктами антропогенной деятельности и могут быть токсичны сами по себе (например, озон при избыточной концентрации) или вызывать формирование токсичных веществ (ПАН и др.).
водородных радикалов, оксидов азота, метана и др.) играет не меньшую роль в ее химии, чем присутствие основных компонентов (N2 и О2). Несмотря на чрезвычайно низкое содержание и, зачастую, короткое время существования МТС способны влиять на концентрации других веществ (О3, СН4 и др.), определяющих радиационно-тепловой режим системы Земля—атмосфера. Избыточные концентрации некоторых тропосферных МГС (НОх NOx и др.) являются продуктами антропогенной деятельности и могут быть токсичны сами по себе (например, озон при избыточной концентрации) или вызывать формирование токсичных веществ (ПАН и др.).