Большинство аналитических уравнений состояния включают давление в явном виде и по форме похоже на полином по обратным степеням объемов. Вириальное уравнение состояния имеет вид
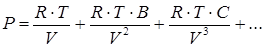 (4.17)
(4.17)
Одной из причин популярности вириального уравнения состояния является то, что коэффициенты B, C,... могут быть связаны с параметрами, характеризующими межмолекулярную потенциальную функцию. В большинстве случаев при практических расчетах используется усеченное до второго вириального коэффициента уравнение состояния
 . (4.18)
. (4.18)
Это уравнение не следует использовать при плотности, превышающей половину значения критической плотности  .
.
Для расчета второго вириального коэффициента “B” предложены методы, основанные на принципе соответственных состояний. Один из них развит Цонопулосом и основан на предложенном Питцером и Керлом разложении в ряд.
Для неполярных молекул:
 , (4.19)
, (4.19)
где  ; (4.20)
; (4.20)
 . (4.21)
. (4.21)
Для полярных молекул Цонопулос предложил дополнить систему уравнений для неполярных веществ еще одним членом:
 . (4.22)
. (4.22)
Для соединений, не склонных к специфическим взаимодействиям (не проявляющих водородных связей), коэффициент b может быть принят равным нулю. Значение коэффициента a для кетонов, альдегидов, эфиров и нитрилов при этом вычисляется по уравнению
 , (4.23)
, (4.23)
где  . (4.24)
. (4.24)
Здесь µp - дипольный момент молекулы в дебаях; критическое давление - в физических атмосферах, критическая температура - в градусах Кельвина. Для расчета второго вириального коэффициента полярных молекул может быть использован также метод, предложенный Ветере и не требующий знания дипольного момента:
 ; (4.25)
; (4.25)
 ; (4.26)
; (4.26)
 ; (4.27)
; (4.27)
 , (4.28)
, (4.28)
где ацентрический фактор, а значение p вычисляется по уравнению
 . (4.29)
. (4.29)
Здесь Tb - нормальная температура кипения вещества, К; М - молекулярная масса.
Если рассчитанное значение p отрицательно, то его следует принять равным нулю.
Метод Ветере непригоден для воды, метанола и этанола.
Пример 4.4
Для изобутилбензола с использованием вириального уравнения состояния показать зависимость P–V при 500, 657, 1170 К и молярном объеме 100-3000 см3. Критический объем изобутилбензола равен 480 см3/моль.
Решение:
1. Изобутилбензол имеет дипольный момент 0,3 D, т.е. является веществом слабополярным. Для прогнозирования P-V-T соотношений используем корреляции Цонопулоса для неполярных веществ и усеченное (до второго вириального коэффициента включительно) вириальное уравнение состояния. Прежде всего, представим зависимость второго вириального коэффициента В от температуры с включением в расчет интересующего диапазона 500-1170 К. Результаты расчета приведены в табл. 4.4 и на рис. 4.4. Для 500 К имеем
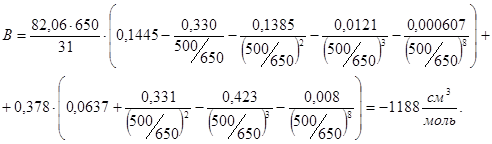
Таблица 4.4
Второй вириальный коэффициент изобутилбензола
| Т, К | В, см3/моль | Т, К | В, см3/моль |
| -7330 | -497 | ||
| -3623 | -414 | ||
| -2267 | -346 | ||
| -1188 | -244 | ||
| -925 | -204 | ||
| -740 | -170 | ||
| -587 | -83 |

Рис. 4.4. Второй вириальный коэффициент изобутилбензола
2. Для заданных температур и дискретных значений молярных объемов вычислим значения давлений. Для 500 К и 1000 см3/моль имеем
P = 82,05·500/1000+82,05·500·(-1188)/10002 = -8 атм.
Результаты расчета приведены в табл. 4.5 и на рис. 4.5.
Область молярных объемов V < 960 см3 находится за пределами корректного применения вириального уравнения состояния.
Таблица 4.5
Давление изобутилбензола при 500, 657 и 1170 К,
вычисленное по вириальному уравнению состояния
| V, см3/моль | P, атм при температуре Т, К | ||
| 500 К | 657 К | 1170 К | |
| -4464 | -2625 | ||
| -405 | -172 | ||
| -113 | -19 | ||
| -41 | |||
| -15 | |||
| -10 | |||
| -8 | |||

Рис. 4.5. Вириальное уравнение состояния
Ось давления содержит и положительные и отрицательные значения. Положительные – привычные давления сжатия, отрицательные – соответствуют растяжению, которому можно подвергнуть плотную жидкость и кристалл.
Первые наблюдения над изменениями характеристик веществ, происходящими в критическом (жидкость-пар) состоянии, были проведены при нагревании жидкостей в запаянных стеклянных трубках. Метод экспериментального определения критических температур по исчезновению мениска в ампуле в настоящее время реализован А.Г. Назмутдиновым на кафедре ТО и НХС СамГТУ.
В общем случае критическое состояние может характеризовать не только равновесие “жидкость-пар”, а и состояние, например, двухфазной системы, в котором сосуществующие в равновесии несмешивающиеся жидкости становятся тождественными по всем своим свойствам. Для решения задач, рассматриваемых в данном пособии, важно парожидкостное равновесие.
Параметры системы, представленной индивидуальным веществом и находящейся в критическом состоянии (давление  , температура
, температура  , объем
, объем  ), называются критическими свойствами этого вещества. При температурах выше
), называются критическими свойствами этого вещества. При температурах выше  сосуществование рассматриваемых фаз в равновесии невозможно, система превращается в гомогенную. В этом смысле критическое состояние является предельным случаем двухфазного равновесия.
сосуществование рассматриваемых фаз в равновесии невозможно, система превращается в гомогенную. В этом смысле критическое состояние является предельным случаем двухфазного равновесия.
В критическом состоянии поверхностное (межфазное) натяжение на границе раздела сосуществующих фаз равно нулю, поэтому вблизи критического состояния легко образуются системы, состоящие из множества капель или пузырьков (эмульсии, аэрозоли, пены). Вблизи критического состояния резко возрастает величина флуктуаций плотности (в случае чистых веществ) и концентраций компонентов (в многокомпонентных системах), что приводит к значительному изменению ряда физических свойств вещества. Наличие флуктуаций плотности приводит к оптической неоднородности системы, к рассеянию света. Это явление носит название критической опалесценции. Рассеяние света служит источником сведений о величине и характере флуктуаций в критической области.
При приближении к критическому состоянию свойства сосуществующих фаз (плотность, теплоемкость и др.) изменяются резко, но без скачка. Поэтому критическое состояние наблюдается лишь при равновесии изотропных (isos - греч., равный; tropos- греч., свойство), т.е. равных во всех направлениях фаз (жидких или газовых) или кристаллических фаз с одинаковым типом решетки. Независимо от природы сосуществующих фаз (типа двухфазного равновесия) и числа компонентов в критическом состоянии система имеет вариантность на 2 меньше, чем в обычном гомогенном состоянии, т.е. число степеней свободы равно нулю.
В чистых веществах (однокомпонентных системах) критическое состояние всегда имеет место для равновесия “жидкость-пар”, если вещество при критических параметрах стабильно. На диаграмме состояния критическому состоянию отвечает конечная точка кривой равновесия, называемая критической точкой. Изотермы на диаграммах P-V (рис. 4.2, 4.3) при температурах ниже  представляют собой ломаные линии. При критической температуре изотерма является плавной кривой, имеющей точку перегиба с горизонтальной касательной. Выше
представляют собой ломаные линии. При критической температуре изотерма является плавной кривой, имеющей точку перегиба с горизонтальной касательной. Выше  ни при каких давлениях невозможно сосуществование жидкости в равновесии с паром.
ни при каких давлениях невозможно сосуществование жидкости в равновесии с паром.
Критическая температура чистого (индивидуального) вещества может быть определена как максимальная температура, при которой жидкая и паровая фазы еще могут сосуществовать в равновесии. Давление паров при этой температуре называется критическим давлением, а объем, отнесенный к одному молю или другой единице массы вещества, - критическим молярным или удельным объемом соответственно.
Упрощенное представление о критической точке может быть получено на основе рассмотрения кинетической обстановки в жидкой фазе. Потенциальная энергия взаимного притяжения молекул, обусловливающая существование жидкой фазы, уравновешивается в какой-то степени кинетической энергией молекул. Последняя стремится хаотически рассеять все частицы жидкости. Таким образом, давление паров есть результат того, что некоторые из молекул жидкости имеют достаточно высокую кинетическую энергию, чтобы вырваться из поля действия сил сцепления жидкости. С увеличением температуры жидкости кинетическая энергия молекул возрастает, силы же сцепления меняются незначительно. Температура, при которой средняя молекулярная кинетическая энергия становится равной потенциальной энергии притяжения, называется критической, так как при более высоком значении температуры существование жидкой фазы становится невозможным.
Математическим критерием критического состояния являются равенства
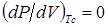 ; (4.2)
; (4.2)
 , (4.3)
, (4.3)
из которых следует, что критическая температура ( ) - это точка перегиба изотермы на плоскости P-V при критических давлении и объеме. Согласно этим уравнениям, в критическом состоянии давление в системе не изменяется при изотермическом изменении объема. Слабая зависимость давления от объема может сохраняться в значительном интервале температур вдали от критической точки. Иногда критическое состояние наблюдается в равновесии двух кристаллических модификаций, параметры которых сближаются с ростом давления и температуры и становятся идентичными в критической точке.
) - это точка перегиба изотермы на плоскости P-V при критических давлении и объеме. Согласно этим уравнениям, в критическом состоянии давление в системе не изменяется при изотермическом изменении объема. Слабая зависимость давления от объема может сохраняться в значительном интервале температур вдали от критической точки. Иногда критическое состояние наблюдается в равновесии двух кристаллических модификаций, параметры которых сближаются с ростом давления и температуры и становятся идентичными в критической точке.
В двойных системах, как и в чистых веществах, равновесное сосуществование жидкой и паровой фаз всегда заканчивается критическим состоянием. Для некоторых систем с ограниченной взаимной растворимостью компонентов существуют, кроме того, критические состояния как предельные случаи равновесного сосуществования двух жидких или двух кристаллических фаз (твердых растворов). В некоторых случаях возможное в принципе критическое состояние может не реализоваться, если на рассматриваемое двухфазное равновесие накладывается равновесие других фаз. Например, при понижении температуры или повышении давления начинается кристаллизация одной или обеих жидких фаз.
Равновесие “жидкость-газ” для смесей на плоской диаграмме состояния в координатах “давление-состав” изображается изотермами, которые состоят из кривых конденсации и кривых кипения. Эти кривые замыкаются в критических точках, геометрическое место которых является проекцией пространственной критической кривой в данной системе координат. Критическая кривая заканчивается в критических точках чистых компонентов. По мере повышения температуры область двухфазного состояния системы уменьшается, стягиваясь при  в точку, совпадающую с критической точкой более летучего компонента.
в точку, совпадающую с критической точкой более летучего компонента.
Равновесие “жидкость-жидкость” может заканчиваться верхней критической точкой смешения (растворимости) или нижней критической точкой смешения (растворимости), в зависимости от того, увеличивается или уменьшается взаимная растворимость компонентов с повышением температуры. В общем случае система может иметь обе критические точки; пограничная кривая, отделяющая область гомогенного состояния системы при любых составах от области ее расслаивания на две жидкие фазы, имеет вид замкнутого овала.
В двойных системах с ограниченной взаимной растворимостью газов наблюдается критическое состояние для равновесия “газ-газ”. Экспериментально обнаружены только нижние критические точки смешения газов, хотя в принципе возможно существование и верхних критических точек. Критическое состояние газов бывает двух типов. Первый обнаружен в смесях, одним из компонентов которых является гелий. Расслаивание газовой смеси начинается в критической точке менее летучего компонента. По мере повышения температуры интервал составов, соответствующих двухфазному состоянию газовой смеси, сужается, а давление повышается. Вся критическая кривая расположена при более высоких давлениях и температурах, чем кривые равновесия “жидкость-пар”. В случае критического состояния второго типа расслаивание газовой смеси начинается при температуре, для которой еще наблюдается равновесие “жидкость-пар”, т.е. при температуре ниже критической точки менее летучего компонента. Изотерма равновесия “жидкость-газ” соприкасается с изотермой равновесия “газ-газ” в точке, которая является двойной критической точкой.
Критические кривые могут иметь особые точки, в которых термодинамическое поведение системы отличается от поведения в остальных точках критической кривой. Особыми точками являются, например, критические точки равновесия “жидкость-пар” в случае бесконечно разбавленных растворов. Их особенность состоит в том, что в пределах xi – >0 значения некоторых свойств системы зависят от пути подхода к этому пределу. Например, парциальный молярный объем растворителя равен молярному объему чистого растворителя только в том случае, если переход xi – >0 происходит при давлениях и температурах, которые являются критическими параметрами для чистого растворителя. Вдали от критической точки парциальный молярный объем растворителя в бесконечно разбавленном растворе при любых температурах и давлениях не равен молярному объему чистого растворителя. Критическая точка азеотропной смеси и точки минимума и максимума на критической кривой также считаются особыми.
В многокомпонентных системах возможны двухфазные равновесия различных типов, оканчивающиеся критическим состоянием. В тройных системах критические точки образуют критическую поверхность с несколькими особыми точками. Наиболее важно появление критических точек высшего порядка, в которых сливаются критические кривые равновесий “жидкость-пар” (в присутствии второй жидкой фазы) и “жидкость-жидкость” (в присутствии газовой фазы).
Основные положения классической теории критического состояния были сформулированы Дж. Гиббсом и Л.Д. Ландау. Современная теория позволяет предсказать поведение вещества в критическом состоянии по известным свойствам двухфазного состояния. Изучение критического состояния имеет важное практическое значение. Многие технологические процессы протекают в области, близкой к критическому состоянию, или в закритической области параметров. Очевидно, что для проектирования и эксплуатации подобных производств необходимо четко представлять особенности критического состояния.
Установление понятия о критическом состоянии сыграло большую роль в технике сжижения газов. Стали тривиальными примеры, относящиеся к истории получения в жидком состоянии таких газов, как водород (tc = –239,90 С), гелий (–267,9 0 С), неон (–228,7 0 С) и др.