Не будет преувеличением утверждение, что уравнение Ван-дер-Ваальса является наиболее известным из всех существующих на данный момент. Оно впервые сформулировано автором в 1873 г. в диссертации “О непрерывности газообразных и жидких состояний”
Математические выражения, относящиеся к уравнению Ван-дер-Ваальса и широко встречающиеся в литературе, приведены ниже.
Стандартный вид уравнения:
 ; (4.4)
; (4.4)
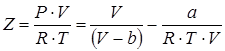 . (4.5)
. (4.5)
Уравнение в виде полинома:
 ; (4.6)
; (4.6)
 . (4.7)
. (4.7)
Вириальный вид уравнения:
 (4.8)
(4.8)
Приведенный вид уравнения:
 , (4.9)
, (4.9)
где  ;
;  ;
; 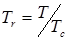 .
.
Параметры, выраженные через критические свойства и полученные из условий (4.2) и (4.3), равны:
 ; (4.10)
; (4.10)
 , (4.11)
, (4.11)
a - параметр, учитывающий действие сил притяжения, b - отталкивания. Последний параметр, называемый эффективным молекулярным объемом, согласно теоретическим расчетам Ван-дер-Ваальса должен в четыре раза превышать действительный объем молекул.
Результаты расчетов, выполненных с использованием уравнения Ван-дер-Ваальса, отличаются невысокой степенью точности, и лишь в редких случаях превосходят средний уровень. В этой связи была проделана большая работа в целях усовершенствования данного уравнения путем установления соотношения его параметров с некоторыми другими свойствами помимо параметров критического состояния, а именно с точкой кипения, плотностью, коэффициентом термического расширения и пр. Тем не менее, до настоящего времени из всех известных модификаций уравнения предпочтение отдается его оригинальной редакции. Несмотря на относительную простоту, уравнение Ван-дер-Ваальса позволяет передать сложность взаимоотношений рассматриваемых параметров - давления, температуры, объема. Для иллюстрации сказанного в примере 4.2 избраны три изотермы: одна из них существенно выше критической температуры, вторая близка к ней, а третья проходит через различные области P-V-T пространства - ненасыщенной жидкости, смеси жидкости и пара, область газообразного состояния вещества.
Пример 4.2
Для изобутилбензола с использованием уравнения состояния Ван-дер-Ваальса показать зависимость P от V при 500, 657, 1170 К и объеме 100-3000 см3/ моль. Критические температура и давление равны 650 К и 31 атм соответственно.
Решение:
1. Вычислим характеристические константы уравнения:
a = 27·82,062·6502/(64·31) = 3,87·107 (см6·атм)/моль2;
b = 82,06·650/(8·31) = 215 см3/моль.
2. Для заданных температур и дискретных значений молярных объемов вычислим значения давлений. Для 500 К и 1000 см3/моль имеем:
Р = 82,06·500/(1000–215)–3,87·107/10002 = 14 атм.
Результаты расчета приведены в табл. 4.2 и на рис. 4.2.
Таблица 4.2
Давление изобутилбензола при 500, 657 и 1170 К, вычисленное по уравнению Ван-дер-Ваальса
| V, см3/моль | P, атм при температуре Т, К | ||
| 500 К | 657 К | 1170 К | |
| -4227 | -4339 | -4705 | |
| -3703 | -4561 | -7367 | |
| -20 | |||
| -1 | |||

Р и с. 4.2. Сопоставление изотерм Ван-дер-Ваальса (В-д-В)
для изобутилбензола с изотермами идеального газа (ид. газ)
Анализ результатов, представленных на рис. 4.2, показывает, что изотермы реального газа имеют достаточно сложный вид. В области температур существенно выше критической вид изотермы для изобутилбензола близок к гиперболическому, так же как и для идеального газа. При температуре, ненамного превосходящей критическую, изотерма не имеет точки перегиба, но меняет свою кривизну. Область ниже критической температуры характеризуется наличием на изотерме экстремумов и резким изменением давления в диапазоне малых молярных объемов. В области больших молярных объемов вид изотермы для изобутилбензола совпадает с видом изотермы для идеального газа, рассчитанной по уравнению Ван-дер-Ваальса, только в области высоких значений мольного объема.