Определите тип химической связи и составьте схему ее образования для веществ с формулами:
1) Nа2+1О-2
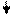


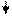


 Так как Nа – типичный металл (находится в lА группе), следовательно, связь ионная:
Так как Nа – типичный металл (находится в lА группе), следовательно, связь ионная:
 Nа· + ·О· + ·Nа → Nа+ [:О:]-2 Nа+
Nа· + ·О· + ·Nа → Nа+ [:О:]-2 Nа+
2) N-3Н3+1 (аммиак)
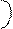
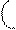
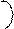
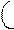 Так как оба элемента – неметаллы с различной ЭО, следовательно связь КП:
Так как оба элемента – неметаллы с различной ЭО, следовательно связь КП:
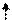

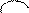
 3Н· + ·N· → Н: N:
3Н· + ·N· → Н: N: 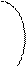 Н; структурная формула Нδ+ Nδ- Нδ+, которая показывает, что
Н; структурная формула Нδ+ Nδ- Нδ+, которая показывает, что
Н Н δ+ все три связи смещены в сторону 
 атома N как более ЭО. Следовательно, степень окисления азота N (число полярных связей) равна -3, и валентность (число всех связей) равна lll.
атома N как более ЭО. Следовательно, степень окисления азота N (число полярных связей) равна -3, и валентность (число всех связей) равна lll.
3) S20
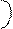
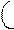 Так как оба атома – неметаллы с одинаковой ЭО, следовательно связь КН:
Так как оба атома – неметаллы с одинаковой ЭО, следовательно связь КН:
:S· + ·S: →:S::S: структурная формула S = S, из которой видно, что обе связи
неполярны, то есть не смещены ни к одному из атомов S.
Следовательно, степень окисления серы равна нулю, а валентность
равна ll.
Упражнение на определение валентности и степени окисления атомов в веществах:
1) N2
Напишем структурную формулу молекулы азота. Так как на внешнем энергетическом уровне атома азота три неспаренных электрона (см. стр. 2), то образуются три ковалентные связи по обменному механизму, каждая связь изображается черточкой N Ξ N. Следовательно, валентность равна lll. Поскольку оба атома имеют одинаковое значение ЭО, полярные (смещенные) связи отсутствуют, следовательно, СО равна нулю. Окончательно запишем N lll.0
2) NF3
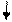

 Структурная формула имеет вид F N F. Ковалентные связи изображаются стрелками в
Структурная формула имеет вид F N F. Ковалентные связи изображаются стрелками в
F
сторону наиболее ЭО атома, т.е. фтора F. Валентность азота lll, СО +3. N lll,+3 F3 l,-1
3) Н2О2 (пероксид водорода)
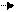
 Учитывая, что Н всегда одновалентен, структурная формула имеет вид Н l,+1 О ll,-1 ―О Н
Учитывая, что Н всегда одновалентен, структурная формула имеет вид Н l,+1 О ll,-1 ―О Н
Обратите внимание, что у кислорода валентность (ll) и СО (-1) не совпадают по значению, так как атом кислорода всего образует две ковалентные связи (валентность ll), но лишь одна полярная (СО равна -1).
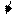
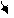 4) С2Н4 (этилен) Н Н
4) С2Н4 (этилен) Н Н

 Это органическое соединение, в которых углерод всегда четырехвалентен: С lѴ,-2 = С
Это органическое соединение, в которых углерод всегда четырехвалентен: С lѴ,-2 = С
Н Н
Из формулы видно, что углерод С образует четыре ковалентные связи (валентность lѴ), две из них смещены в сторону С (степень окисления -2).
3) 
 Валентные возможность атомов химических элементов
Валентные возможность атомов химических элементов
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Чтобы верно оценить валентные возможности атомов, надо рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов для невозбужденного (основного) и возбужденного состояния атома. В возбужденное состояние атом переходит при сообщении ему дополнительной энергии, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали. Атом в возбужденном состоянии обозначается звездочкой. Например, рассмотрим валентные возможности атомов фосфора в основном и возбужденном состояниях:
 15Р 1s22s22p63s23p3 +энергия (Е) 15Р* 1s22s22p63s13p33d1
15Р 1s22s22p63s23p3 +энергия (Е) 15Р* 1s22s22p63s13p33d1
| ↓ | ||||||||
| ↓ | ↓ | ↓ | 3d | |||||
| ↓ | 3р | |||||||
| 3s | ||||||||
| ↓ | ↓ | ↓ | 3d | |||||
| ↓↑ | 3p | |||||||
| 3s | ||||||||
 +Е
+Е
В невозбужденном состоянии атом фосфора имеет три неспаренных электрона на р-подуровне (валентность фосфора lll, например в фосфине РН3, фосфористой кислоте Н3РО3). При переходе в возбужденное состояние один из пары s- электронов может переходить на свободную орбиталь d-подуровня. Атом фосфора теперь имеет пять неспаренных электронов, валентность Ѵ (Р2О5, Н3РО4).
Но валентные возможности атомов не исчерпываются числом неспаренных электронов. При образовании ковалентных связей по донорно-акцепторному механизму реализуются и две другие валентные возможности атомов, которые определяются наличием неподеленных электронных пар и свободных орбиталей, способных дать ковалентную связь по донорно-акцепторному механизму (см. образование иона аммония NН4+).
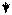 Н три связи образованы по обменному механизму (обозначены стрелками в
Н три связи образованы по обменному механизму (обозначены стрелками в

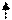 [Н N―Н ]+ сторону наиболее ЭО азота) и одна по донорно-акцепторному. Таким образом,
[Н N―Н ]+ сторону наиболее ЭО азота) и одна по донорно-акцепторному. Таким образом,
Н валентность азота lѴ, а степень окисления -3 (число смещенных связей).
Сделаем общий вывод: валентные возможности атомов химических элементов определяются:
1) числом неспаренных электронов;
2) наличием свободных орбиталей;
3) наличием неподеленных электронных пар.
Задания для работы в классе:
1) Определите валентность и степень окисления атомов в веществах с формулами NН3, ОF2, С2Н2.
2) В какой из молекул ковалентная химическая связь более полярна – в молекуле хлороводорода НСl или молекуле фтороводорода НF?
3) Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
4) Дайте характеристику химической связи в молекуле азота, используя следующие признаки: ЭО связанных атомов, механизм образования, кратность связи (одинарная, двойная, тройная). То же самое для молекул О2, НF, F2.
5) Определите тип связи и рассмотрите схемы ее образования в веществах с формулами:
СаF2, F2, ОF2, К2О, Н2S.
6) Определите валентные возможности атомов хлора в основном и возбужденном состояниях.
Д/з cделайте письменно в рабочих тетрадях.
1) В следующих предложениях вставьте пропущенные слова и выражения: «Ковалентная связь образуется за счет…. По числу общих электронных пар она бывает …. По ЭО ковалентная связь делится на … и …».
2) Определите валентность и степень окисления атомов в веществах с формулами СН4, О2F2, О2.
3) В какой из молекул ковалентная химическая связь более полярна – в молекуле хлороводорода НСl или молекуле метана СН4? Дайте обоснованный ответ.
4) Дайте характеристику химической связи в молекуле водорода, используя следующие признаки: ЭО связанных атомов, механизм образования, кратность связи (одинарная, двойная, тройная). То же самое для молекул N2, РН3 .
5) Определите тип связи и рассмотрите схемы ее образования в веществах с формулами:
ВаО, О2, Н2О.
6) Определите валентные возможности атомов серы в основном и возбужденном состояниях.
7) Расположите в порядке увеличения прочности связи вещества с формулами S2, Сl2,N2 и обоснуйте правильность своего решения. Как будет изменяться длина связи молекул в составленном вами ряду?
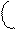 | |||||
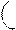 | |||||
 |