Билет №3. Структурная биология
Рибосома (от «рибонуклеиновая кислота» и сома), органоид клетки, осуществляющий биосинтез белка. Представляет собой частицу сложной формы диаметром около 20 нм. Рибосома состоит из 2 неравных субчастиц (субъединиц) – большой и малой, на которые может распадаться (диссоциировать). Различают два основных типа рибосом – эукариотные с константами седиментации: целой рибосомой – 80 S, малой субчастицы – 40 S, большой – 60 S) и прокариотные (соответственно 70 S, 30 S и 50 S). Кроме того, в митохондриях и хлоропластах содержатся мелкие рибосомы (константа седиментации 55 S – 70 S), осуществляющие автономный синтез белка. В бактериальной клетке содержится 104 – 105 рибосом. В состав рибосомы входит рРНК (3 молекулы у прокариот и 4 – у эукариот) и белки. Молекулы рРНК составляют 50 – 63% массы рибосом и образуют её структурный каркас. Каждый из белков рибосом представлен в ней одной молекулой, т.е. на одну рибосому приходится несколько десятков разных белков (около 55 для рибосом прокариот и около 100 для рибосом эукариот). Большинство белков специфически связано с определенными участками рРНК. Некоторые белки – т.н. факторы инициации (начала), элонгации (продолжения) и терминации (окончания) – входят в состав рибосомы только во время биосинтеза белка. В отсутствие биосинтеза белка субчастицы рибосомы находятся в динамическом равновесии с целыми рибосомами. При начале трансляции с малой субчастицей связываются иРНК, формилметионил – тРНК и факторы инициации; затем этот комплекс присоединяется к большой субчастице. Связь оказывается очень прочной и исчезает только после терминации. Ассоциация выделенных субчастиц рибосомы осуществляется только при наличии двухвалентных катионов, в физиологических условиях в ней участвует Mg2+. Рибосома имеет специфические места для присоединения аминоацил-тРНК, пептидил-тРНК, места образования пептидной связи и гидролиза гуанозинтрифосфата, что обеспечивает постепенное скольжение рибосомы вдоль молекулы иРНК при синтезе полипептидной цепи. Одну молекулу иРНК могут одновременно транслировать несколько рибосом, образуя комплекс – полирибосому (полисому). Количество полирибосом в клетке указывает на интенсивность биосинтеза белка. В эукариотных клетках часть рибосом связана специальными белками большой субчастицы с мембранами эндоплазматической сети. Эти рибосомы синтезируют в основные белки, которые поступают в комплекс Гольджи и секретируются клеткой рибосом; расположенные в гиалоплазме (в цитоплазматическом матриксе), синтезируют белки для собственных нужд клетки. У эукариот рибосомы образуются в ядрышке. На ядрышковой ДНК синтезируются предшественники рРНК, которые покрываются поступающими из цитоплазмы рибосомальными белками, расщепляются до нужных размеров и формируют рибосомные субчастицы, которые выходят в цитоплазму. Полностью сформированных рибосом в ядре нет. Основную массу клеточной РНК составляет рРНК. Она обуславливает базофильную окраску ядрышка и участков эргастоплазмы (например, Ниссля вещества в нейронах).
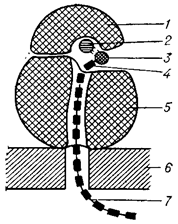
Схема строения рибосомы, сидящей на мембране эндоплазматической сети: 1 – малая судъединица; 2 – иРНК; 3 – аминоацил – тРНК; 4 – аминокислота; 5 – большая субъединица; 6 – мембрана эндоплазматической сети; 7 – синтезируемая полипептидная цепь.
Принцип действия антибиотиков. https://newtonew.com/science/antibacterials
Антибиотики — вещества природного происхождения, обладающие свойством уничтожения других живых микроорганизмов или препятствования их развитию.
В фармакологии используются следующие виды антибиотиков:
· природные
· полусинтетические
· синтетические
Помимо нормального функционирования всех систем и органов тела, здоровье человека зависит от того, насколько жизнеспособны бактерии, которые являются неотъемлемой частью всего организма.
Основная суть действия бактериального биологического щита состоит в том, что бактериальная флора условно разделена на два лагеря: мутуалистические (полезные) симбионты и патогенные (болезнетворные) бактерии. Когда набирает силу лагерь патогенов, в том месте, где произошло скопление этих патогенов, начинается воспалительный процесс.
Причин, по которым некоторые патогены получают преимущество, несколько:
· воздействие на организм неблагоприятных факторов (охлаждение, отравление токсичными соединениями, недостаток витаминов и т.д.);
· проникновение в организм постороннего инфекционного агента, который быстро нарушает установленное равновесие в свою пользу;
· ослабление иммунитета (недостаточное количество вырабатываемых организмом антител, чтобы вовремя обезвредить бактериальные клетки-патогены).
Сегодня эти медицинские препараты группируют по нескольким признакам. Один из основных признаков – принцип действия:
бактерицидные (от их действий бактерии погибают);
бактериостатические (от их действий бактерии теряют способность развиваться и размножаться).
Следующий вариант классификации – группировка по спектру действия. Несмотря на богатство бактериальной микрофлоры, основных групп препаратов только пять. В каждой группе есть внутреннее деление: антибиотики широкого и узкого спектра действия.
Группы образуются по следующим направлениям:
· Препараты, направленные на борьбу с широким спектром патогенных как грамположительных, так и грамотрицательных микроорганизмов (тетрациклины и стрептомицины).
Грамположительные микробы опасны для человека. К ним относятся стрептококки, в том числе возбудители пневмонии, стафилококки.
Грамотрицательные — кишечная палочка, сальмонелла, шигелла, клебсиелла и т.д.
Антибиотики широкого спектра действия этой группы эффективно борются с бактериями, которые являются частью нормальной микрофлоры организма, но по определенным причинам становятся причиной заболеваний. К антибиотикам узкого спектра действия относятся препараты, которые убивают только грамотрицательные или только грамположительные микробы.
· Противотуберкулезные антибактериальные средства.
В этой группе также есть антибиотики широкого и узкого спектра действия. Например, противотуберкулезный антибиотик нового поколения «Рифамицин» борется не только с туберкулезной палочкой, но и с грамотрицательными и грамположительными патогенами, которые могут присутствовать в очаге воспаления.
· Противогрибковые антибактериальные средства.
Есть препараты широкого спектра, которые эффективно используются при разных грибковых инфекциях (кандидозы, микозы, аспергиллезы), а есть узкого спектра, которые можно принимать только при кандидозах и т.д.
Антивирусные антибиотики.
До недавнего времени считалось, что антибиотики не могут воздействовать разрушающе на вирусы, но в последнее время были разработаны медицинские препараты, которые также успешно разрушают структуру вируса, как и структуру бактериальной клетки.
Антибиотики, которые назначаются при опухолевых заболеваниях.
Среди таких препаратов нет лекарств широкого спектра воздействия.
Лекарства узкого спектра направлены только на борьбу с конкретным возбудителем. И если неправильно определить возбудителя, то, принимая антибиотик узкого спектра, можно причинить себе только вред.
2. Рентгеноструктурный анализ. Кристаллическая решетка. Кристаллизация белков.
Рентгеноструктурный анализ — один из дифракционных методов исследования структуры вещества. В основе данного метода лежит явление дифракции рентгеновских лучей на трёхмерной кристаллической решётке. Явление дифракции рентгеновских лучей на кристаллах открыл Лауэ, теоретическое обоснование явлению дали Вульф и Брэгг (условие Вульфа — Брэгга). Как метод, рентгеноструктурный анализ разработан Дебаем и Шеррером. Метод позволяет определять атомную структуру вещества, включающую в себя пространственную группу элементарной ячейки, её размеры и форму, а также определить группу симметрии кристалла.
Криста́ллы (от греч. κρύσταλλος первоначально — «лёд», в дальнейшем — «горный хрусталь; кристалл») — твёрдые тела, в которых частицы (атомы и молекулы) расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Кристаллической решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Решетку можно представить себе как систему одинаковых параллелепипедов. Каждый такой параллелепипед носит название «элементарная ячейка кристалла», которая описывается шестью параметрами: длинами ребер (a, b, c) и углами между ними (α, β, γ).
Операции симметрии
• Отражение в плоскости симметрии
• Поворот вокруг оси (поворотная симметрия)
• Отражение в центре симметрии (инверсия)
• Перенос (трансляция) фигуры на расстоянии
• Винтовые повороты
Рентгеновские лучи имеют длины волн 0,01-10 Å (1 Å=10-8 см), в то время как расстояния между атомами кристаллической решетки имеют порядок одного ангстрема. Поскольку, в отличие от видимого света, эти расстояния могут оказаться примерно одного порядка, для рентгеновских лучей с кристалл может служить трехмерной дифракционной решеткой.
Закон Брэгга–Вульфа: разность хода лучей, отраженных от соседних кристаллических плоскостей, характеризуемых индексами hkl и межплоскостным расстоянием dhkl, должна быть пропорциональна длине волны: 2𝑑ℎ𝑘𝑙 sin 𝜃ℎ𝑘𝑙 = 𝑛𝜆 dhkl — расстояние между кристаллическими плоскостями, n – порядок отражения (целое число, указывающее сколько длин волн укладывается в разности хода лучей, отраженных соседними плоскостями); λ — длина волны падающего излучения, θhkl – угол скользящего падения (между падающим пучком рентгеновских лучей и отражающей плоскостью). Таким образом, при известных длине волны и межплоскостном расстоянии мы можем определить, возникнет ли дифракционный луч и каково будет его направление.
Результат эксперимента и его связь с исследуемой структурой Монохроматическое рентгеновское излучение, проходя через кристалл, рассеивается, в основном, на электронных оболочках периодически повторяющихся атомов и образует дифракционную картину, или рентгенограмму. Поэтому экспериментальные рентгеновские данные позволяют судить об особенностях расположения электронов в элементарных кристаллических ячейках.
Результат эксперимента и его связь с исследуемой структурой Электрон обладает волновыми свойствами, и его положение в пространстве характеризуется не точными координатами, а функцией распределения электронной плотности ρ(r), которая дает среднее по времени число электронов, приходящееся на 1 А3 (кубический Ангстрем). На основании этой функции можно судить о расположении атомов в элементарных ячейках, т.к. каждому атому соответствует сгусток электронной плотности определенной величины. Таким образом, при обработке данных рентгеновского эксперимента нужно решить две задачи: 1. Из данных рентгенограммы получить карту распределения электронной плотности ρ(r) в кристалле исследуемого объекта. На этом этапе возникает принципиальная трудность, связанная с невозможностью получить из эксперимента всю информацию, необходимую для восстановления исследуемой структуры. Для получения недостающей части информации используют различные обходные пути. Но универсального пути нет, и в каждом случае исследователь выбирает наиболее подходящий, основываясь на своем опыте и интуиции. 2. На основании карты распределения электронной плотности ρ(r) определить положения атомов в исследуемом объекте. Для решения этой задачи структура многократно подвергается программной обработке и ручной доводке для достижения наилучшего совпадения с электронной плотностью.
Кристаллизация Необходимое условие кристаллизации - наличие пересыщенного раствора Для получения такого раствора используют различные способы. o Один из них заключается в постепенном удалении растворителя обычным испарением, что приводит к росту концентрации вещества в растворе, который в какой-то момент становится пересыщенным. o Другой способ связан с использованием температурной зависимости растворимости. Например, если растворимость с увеличением температуры повышается, можно приготовить насыщенный раствор при более высокой температуре, а затем медленно охладить его. Благодаря понижению растворимости в процессе охлаждения получается пересыщенный раствор. o Третий способ связан с введением в раствор какого-либо вещества, вызывающего понижение растворимости. В качестве таких веществ используют либо соли, либо органические растворители. Кроме того, растворимость белков и нуклеиновых кислот сильно зависит от pH раствора, это тоже можно использовать для получения пересыщенных растворов.
Кристаллизация Наиболее широко используемыми экспериментальными методами осаждения беков являются так называемая «висячая капля» и «сидячая капля», в основе которых лежит создание пресыщенного раствора в капле с образцом путем медленного увеличения концентрации макромолекулы и осадителя за счет диффузии паров летучих веществ.
Кристаллизация белков и установление их структур являются одними из самых перспективных направлений современной биологии. В их основе лежит свойство биомолекул образовывать кристаллы, способныe рассеивать рентгеновские лучи. 3акон Брэгга, описывающий зависимость между углами и фазами падающих и отраженных волн и расстояниями между атомами в кристаллической решетке, позволяет воссоздать трехмерную кристаллическую структуру по картине дифракции кристаллами рентгеновских лучей.
Кристаллизация белков используется:
а) как завершающая стадия очистки,
б) для доказательства гомогенности белка,
в) как метод стабилизации при хранении (многие фирмы продают чистые ферменты в виде суспензии кристаллов, помещенных в раствор сульфата аммония),
г) для определения третичной структуры белков методом рентгеноструктурного анализа.
Кристаллы растут из пересыщенных растворов вследствие агрегации высокоупорядоченным образом. Выращивание кристаллов занимает много времени, особенно чтобы получить более крупные кристаллы, пригодные для рентгеноструктурного анализа. Чаще всего в таблице, отражающей ход очистки белка, кристаллизация представлена в качестве последнего этапа. Это указывает на то, что фермент получен в достаточно чистом состоянии, и такой кристаллический препарат пригоден для длительного хранения. Но кристаллы могут образовываться и в очень разнородных смесях белков. Если примеси не находятся в перенасыщенном состоянии, то агрегировать будет тот белок, который присутствует в этом состоянии, и могут образоваться его кристаллы.
Например, метод очистки кроличьей альдолазы заключался в том, что к мышечному экстракту добавляли сульфат аммония до 50% насыщения, осадок удаляли. В надосадочной жидкости альдолаза составляла около 15% от всех белков. При увеличении концентрации сульфата аммония до 52% насыщения альдолаза начинала медленно кристаллизоваться. Отсюда следует, что само образование кристаллов фермента не может служить доказательством того, что раствор, из которого он выпал, содержит чистый фермент.
Методы кристаллизации
Чтобы началась кристаллизация, необходимо создать такие условия, в которых белковый раствор становится перенасыщенным, что приводит к белок-белковой агрегации. Для этой цели используют осадители (вещества, уменьшающие растворимость): сульфат аммония, полиэтиленгликоль, органические растворители. Обычно требуется тщательное изучение условий кристаллизации конкретного белка: рН, концентрации буфера и осадителя, ионов металлов.
Используют следующие приемы:
1. равновесный диализ против осадителя,
2. диффузия паров летучих веществ (методы «висящей и «сидящей» капли).
Осадитель помещают на дно стаканчика, капля концентрированного раствора белка находится на внутренней стороне стеклышка, закрывающего этот стакан. За счет диффузии паров происходит медленное возрастание концентрации осаждающего вещества в капле раствора белка. Раствор белка может также содержать следы ионов металлов. Например, известно, что для кристаллизации инсулина необходимы ионы цинка.
В этом методе раствор белка помещают на пьедестал, возвышающийся над резервуаром с осадителем.
3. метод свободной диффузии
Концентрированные растворы белка и осадителя наслаиваются, идет диффузия. В отличие от метода 2 происходит быстрое пересыщение белкового раствора и образование центров кристаллизации. При дальнейшей диффузии идет понижение концентрации белка и осадителя.
Очень важна скорость образования зародышей кристаллов, которая зависит от концентрации белка, а чем меньше кристаллов, тем больше их размер. Скорость же роста кристаллов зависит от растворимости белка, т.е. от концентрации растворителя. Иногда чтобы вырастить большие кристаллы, в раствор белка вносят затравку – мелкие кристаллы этого белка.
Кристалл белка может храниться полгода в специальном растворе, который не содержит белка. Подбирается такая концентрация осадителя, при которой кристалл не растворялся бы и не трескался. Кроме того, в раствор добавляют азид натрия или толуол против бактериального заражения.
https://chem21.info/info/629338/