В стакан № 1 с катионитом КУ-2 ( – сульфокислота) мерным цилиндром налейте 40 мл раствора сульфата меди (II) с концентрацией 0,05 М. Перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени (1, 2 или 3 минуты). Перемешивание обеспечивает равномерную сорбцию катионитом ионов меди (II) из раствора.
– сульфокислота) мерным цилиндром налейте 40 мл раствора сульфата меди (II) с концентрацией 0,05 М. Перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени (1, 2 или 3 минуты). Перемешивание обеспечивает равномерную сорбцию катионитом ионов меди (II) из раствора.
СuSO4 + 2  ® H2SO4 + ® H2SO4 + 
|
Далее аккуратно слейте с катионита раствор в стакан № 2.
В полученном растворе определите концентрацию ионов меди (II) комплексонометрическим титрованием с мурексидом.
Определение концентрации ионов меди (II) комплексонометрическим титрованием с мурексидом
Отберите пипеткой 10 мл раствора меди (II) из стакана № 2 и перенесите его в коническую колбу для титрования. В эту же колбу добавьте 5 мл ацетатного буферного раствора, измерив его объем с помощью мерного цилиндра и 2/3 мерной фарфоровой ложки индикатора – мурексида. Смесь перемешайте и оттитруйте раствором трилона Б концентрацией 0,05 М до изменения окраски из желто-оранжевой в сиренево-малиновую в точке стехиометричности. Измерьте объем израсходованного на титрование раствора трилона Б (Трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты ЭДТА, C10H14O8N2Na2·2H2O, условная формула Na2H2Y). В реакции участвуют ионы – H2Y2-:
Сu2+ + H2Y2- = CuY2- + 2H+
Титрование проводят минимум дважды.
Оформление опыта
Результаты титрования запишите в таблицу № 2.
Запишите значения объёмов трилона Б и определите средний результат.
Рассчитайте массу m1 ионов меди (II) до сорбции, используя исходную концентрацию ионов меди (II). Объем исходного раствора сульфата меди,  = 40 мл.
= 40 мл.
 =
= 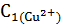 ∙
∙  ∙
∙ 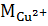 ,г
,г
Рассчитайте концентрацию C2 ионов меди (II) после сорбции, используя закон стехиометрии:
|
|
 ∙
∙  = Стрилон Б ∙Vтрилон Б,
= Стрилон Б ∙Vтрилон Б,
где  – объем пробы, взятый на титрование, 10 мл;
– объем пробы, взятый на титрование, 10 мл;
 =
= 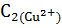 , моль/л
, моль/л
Рассчитайте массу m2 ионов меди (II) в растворе после сорбции (объем раствора после сорбции практически не меняется,  =
=  ):
):
 =
= 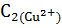 ∙
∙  ∙
∙ 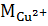 , г,
, г,
где:  - объем раствора после сорбции равный 40 мл.
- объем раствора после сорбции равный 40 мл.
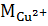 – молярная масса ионов меди.
– молярная масса ионов меди.
Рассчитайте массу сорбированной меди m3
Результаты занесите в таблицу
Таблица 2
| Результаты титрования: | |
| V1 трилона Б = … мл V2 трилона Б = … мл Vср трилона Б = … мл | 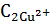 ∙ ∙  = Стрилон Б ∙Vтрилон Б = Стрилон Б ∙Vтрилон Б
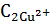 = = 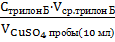
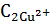 = … моль/л = … моль/л
 = = 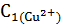 ∙ ∙  ∙ ∙ 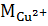 ,г ,г
 = = 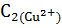 ∙ ∙  ∙ ∙ 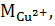 г
m3 – масса сорбированных катионов меди(II)
m3 = m1 –m2 г
m3 – масса сорбированных катионов меди(II)
m3 = m1 –m2
|
Рассчитайте коэффициент распределения ионов меди (II)между жидкой (электролит) и твердой (катионит) фазой по формуле:
Dтв/ж = m3/m2
Сорбция ионов никеля (II) на ионообменной смоле
Выполнение опыта
Сорбция ионов никеля (II) на катионите.
В стакан №1 с катионитом КУ-2 ( – сульфокислота) налейте мерным цилиндром 40 мл раствора сульфата никеля с концентрацией 0,05 М. Перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени (1, 2 или 3 минуты). Перемешивание обеспечивает равномерную сорбцию катионитом ионов никеля(II) из раствора.
– сульфокислота) налейте мерным цилиндром 40 мл раствора сульфата никеля с концентрацией 0,05 М. Перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени (1, 2 или 3 минуты). Перемешивание обеспечивает равномерную сорбцию катионитом ионов никеля(II) из раствора.
NiSO4 +  ® H2SO4 + ® H2SO4 + 
|
По истечении заданного преподавателем времени сорбции аккуратно слейте с катионита раствор в стакан №2.