Лечение нарушений сердечного ритма и проводимости представляет собой один из наиболее сложных разделов клинической педиатрии. Это объясняется многообразием клинических форм аритмий, отсутствием единого понимания механизмов их возникновения, и, следовательно, общепринятых методов лечения. Несмотря на сходство многих подходов, лечение аритмий в детском возрасте отличается от постулатов, принятых в терапевтической практике в силу особенностей физиологии детского организма, отсутствия у детей типичных для взрослых причин развития аритмий и, напротив, существования в некоторые периоды жизни особых условий для их возникновения [1, 2]. Спектр заболеваний, которые могут привести к развитию аритмий в детском возрасте, достаточно широк [3]: 1) органические заболевания сердца (врожденные и приобретенные пороки сердца, кардиты, кардиомиопатии, эндо- и перикардиты, артериальная гипертензия, опухоли сердца), 2) врожденная (генетически обусловленная) патология ионных каналов кардиомиоцитов и проводящей системы сердца, 3) экстракардиальные воздействия, среди которых лидирует патология центральной и вегетативной нервной системы: перинатальные повреждения ЦНС, травмы, опухоли головного мозга, нейроинфекции, наследственные дегенеративные заболевания, вегетативная дистония и др. [4]. В этиологии и патогенезе нарушений ритма также имеют значение особенности строения проводящей системы сердца, гормональные расстройства, токсико-аллергические состояния, патологическая импульсация с внутренних органов, анемия, электролитный дисбаланс, лекарственные интоксикации и т.д. Иногда причину аритмии выяснить не удается, и она расценивается как идиопатическая, однако тщательный диагностический поиск и длительное проспективное наблюдение за подростками с подобными «идиопатическими» желудочковыми нарушениями ритма в Санкт-Петербургском НИИ кардиологии позволили идентифицировать органические болезни миокарда и каналопатии у 40% пациентов. Следовательно, всегда необходимо пытаться выявить и устранить основное заболевание, поскольку это наполовину определяет успех лечения самой аритмии. Условно все нарушения ритма, встречающиеся в детском и подростковом возрасте, можно разделить на тахиаритмии, брадиаритмии и экстрасистолии [3]. Экстрасистолия является наиболее частым вариантом аритмии в детском возрасте (около 50% всех случаев). Тахиаритмии в зависимости от места возникновения классифицируются на суправентрикулярные (СВТ) и желудочковые. Брадиаритмии связаны с нарушением автоматизма и проводимости в области синусового и атриовентрикуляного (АВ) узлов (синдром слабости синусового узла и атрио-вентрикулярные блокады). В лечении аритмий выделяют медикаментозные и немедикаментозные методы. К немедикаментозным относятся хирургические, мини-инвазивные методики (радиочастотная катетерная аблация, криодеструкция и др.) и использование имплантируемых антиаритмических устройств [5]. Данные методики, несомненно, являются высокоэффективными и достаточно безопасными, однако в педиатрической практике (особенно в России) применяются в основном при неэффективности терапевтических подходов. Медикаментозные методы можно условно разделить на экстренную и хроническую фармакотерапию [6]. В экстренном купировании нуждаются нарушения ритма и проводимости сердца с высоким риском развития сердечной недостаточности, остановки кровообращения и внезапной сердечной смерти (ВСС) — желудочковая тахикардия (ЖТ), переходящая в фибрилляцию, и брадиаритмии. В значительно меньшей степени непосредственной причиной остановки кровообращения у детей старше года может стать суправентрикулярная пароксизмальная тахикардия (СВПТ), хотя у детей грудного возраста она представляет значительно большую опасность вследствие быстрого развития сердечной недостаточности [6, 7].
|
|
|
|
По мнению И.А. Ковалева и соавторов [8], для определения тактики оказания неотложной помощи пациенту с нарушением ритма сердца врач прежде всего должен определить, с чем он имеет дело — с тахиаритмией или брадиаритмией. Для этого необходимо произвести подсчет пульса на магистральных артериях или частоты сердечных сокращений (ЧСС) аускультативно. Определить тип аритмии можно после записи стандартной или чреспищеводной ЭКГ, однако при экстренном купировании это не всегда возможно. Обязательной в определении тактики лечения является оценка сознания и гемодинамики пациента (признаки сердечной недостаточности, уровень АД).
Неотложная терапия СВПТ с узким QRS комплексом, а также с широким QRS комплексом в результате функциональной блокады ножек пучка Гиса направлена на прерывание пароксизма тахикардии и нормализацию гемодинамики. При выявлении пароксизма тахикардии (резком изменении состояния ребенка, жалобах на внезапно начавшийся приступ сердцебиения, ощущение подкатывания кома к горлу, головокружение, боли в сердце, одышку, тошноту, потемнение в глазах, ригидном ритме типа «эмбриокардии» с ЧСС около 180-220 в минуту) неотложную терапию начинают с вагусных проб [6-8], которые проводятся в следующем порядке:
|
|
— переворот вниз головой (у детей до года) или стойка на руках (у детей старшего возраста); проба Ашнера — надавливание на глазные яблоки (противопоказана при миопии высокой степени);
— проба Вальсальвы (натуживание); задержка вдоха; аппликация холода на нижнюю часть лица;
— массаж каротидного синуса, с одной стороны, нажатие на корень языка, массаж солнечного сплетения.
В первые 20-25 мин. приступа вагусные пробы наиболее эффективны и прерывают пароксизм в 50-60% случаев при атрио-вентрикулярных реципрокных тахикардиях с участием дополнительного проводящего пути (синдроме WPW, CLC и др.) и в 15-50% случаев при АВ узловых реципрокных тахикардиях. Если на фоне стимуляции блуждающего нерва сохраняется гемодинамически стабильная СВПТ, применяют лекарственные препараты (рисунок 1).
Рисунок 1. Алгоритм неотложной помощи при тахиаритмиях у детей
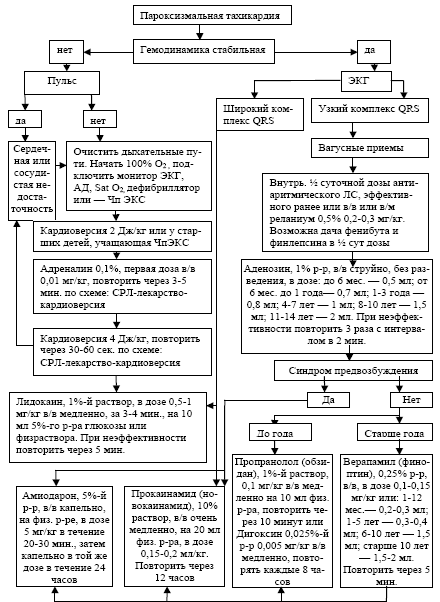
Неотложную терапиюначинают с внутривенного введения 1%-ного р-ра аденозина или АТФ [6-10]. Препарат вводят струйно быстро (за 3-4 с.) без разведения в дозе 0,1 мг/кг или ориентировочно в зависимости от возраста: 0,5мл (детям до 6 мес.), 0,8 мл (6-12 мес.), 1 мл (детям 1-7 лет), 1,5 мл (8-10 лет), 2 мл (подросткам). При неэффективности введение можно повторить еще дважды с интервалом не менее двух минут. Клиническая эффективность аденозина связана со стимуляцией пуриновых рецепторов (благодаря чему аденозин замедляет проведение через АВ-узел, прерывает цепь ри-ентри и способствует восстановлению синусового ритма) и обусловлена быстрым началом, короткой продолжительностью действия (что позволяет безопасно применять и другие противоаритмические средства) и минимальными быстропроходящими побочными эффектами (кашель, чувство жара, гиперемия, брадикардия). Сохраняет свою актуальность и купирование СВПТ (особенно АВ узловой ри-ентри тахикардии) верапамилом (изоптином, финоптином). Хотя у детей раннего возраста препарат может вызывать брадикардию и артериальную гипотонию [11]: 0,25%-ный р-р препарата вводят в/в в дозах: до 1 мес. — 0,2-0,3 мл; до 1 года — 0,3-0,4 мл; 1-5 лет — 0,4-0,5 мл; 5-10 лет — 1,0-1,5 мл, старше 10 лет — 1,5-2,0 мл. Верапамил противопоказан при тахикардии неясной этиологии с широким QRS-комплексом, в т.ч. главным образом при антидромной реципрокной тахикардии у пациентов с синдромом WPW, так как возможна ее трансформация в фибрилляцию желудочков вследствие ускорения антероградного проведения по дополнительному проводящему пути. У больных с синдромом WPW в качестве средства второй линии возможно в/в введение 2,5%-ного р-ра гилуритмала (аймалина) в дозе 1 мг/кг, но не более 50 мг или 5%-ного р-ра амиодарона (кордарона) в/в в начальной дозе 5 мг/кг в течение 20-30 минут с переходом на поддерживающую — 0,5 мг/мин в течение 3-6 ч., но не более 10 мг/кг/сут. или 10%-ного р-ра прокаинамида (новокаинамида) в/в медленно в дозе 0,15-0,2 мл/кг, максимально до 20 мг/кг [12]. Все препараты перед введением предварительно растворяются 5-10 мл 5%-ого р-ра глюкозы или физраствора. Возможная артериальная гипотензия при введении прокаин амида предупреждается введением 1%-ного р-ра мезатона в дозе 0,1 мл/год жизни, но не более 1,0 мл. У детей раннего возраста при неэффективности перечисленных мероприятий возможно введение дигоксина (в/в медленно на физрастворе в дозе 0,1-0,3 мл) или β-блокатора пропранолола (0,05-0,1 мг/кг в/в струйно медленно в разведенном виде, максимальная разовая доза 1 мг, введение можно повторить 3-кратно с интервалом в 10 минут). Согласно последним рекомендациям, и пропранолол (обзидан), и дигоксин более эффективны у детей с предсердной и АВ узловой эктопической тахикардией, а последний может быть даже опасен у больных с синдромом WPW. Пропранолол противопоказан при бронхиальной астме, нарушении АВ проведения, артериальной гипотензии, синдроме синусового узла. Действие антиаритмических препаратов при СВПТ усиливается при совместном использовании транквилизаторов с мембраностабилизирующим эффектом (реланиум, тазепам, феназепам) [6]. М.А. Школьникова (1999) предлагает в качестве премедикации использовать половинные суточные дозы фенибута и финлепсина [3]. В случае наличия у пациента нестабильной гемодинамики (синкопе или пресинкопе, сердечная недостаточность, выраженная гипотензия, шок), что особенно часто отмечается у детей 1 года жизни с АВ узловой ри-ентри тахикардией, необходимо после предварительной седатации/анальгезии использовать синхронизированную кардиоверсию (мощность разряда 0,5-1 Дж/кг) [8, 12]. При неэффективности мощность повторного воздействия может быть увеличена до 2 Дж/кг, но каждый последующий шок должен наноситься как минимум через 2 мин. У более старших детей в аналогичных случаях может быть использована чреспищеводная учащающая или сверхчастая электрокардиостимуляция предсердий. При наличии рефрактерной к антиаритмическим препаратам СВПТ, сопровождающейся клиническими симптомами (синкопе) следует у пациента любого возраста решить вопрос о выполнении радичастотной аблации (РЧА) [6-9, 12]. Хотя в раннем возрасте данная процедура выполняется нечасто, ибо, начавшись в периоде новорожденности, СВПТ в большинстве случаев спонтанно прекращается к 1-1,5 годам [9, 13].
При пароксизме трепетания предсердий у новорожденных, в случае нестабильной гемодинамики, при наличии очень высокой ЧСС (более 300 у новорожденных и детей раннего возраста и более 240 в минуту — у школьников), выявлении уширенных деформированных комплексов QRS на ЭКГ показана немедленная синхронизированная кардиоверсия [8, 14]. Вышеперечисленные признаки могут свидетельствовать о наличии скрытых дополнительных проводящих путей и быть причиной трансформации трепетания предсердий в фибрилляцию желудочков. У детей более старшего возраста без синдрома WPW возможно в/в введение дигоксина (0,025%-ный р-р в дозе 0,01-0,02 мг/кг/сут в 3 введения в течение 3 дней) с последующим назначением внутрь. При удовлетворительном состоянии и стабильной гемодинамике можно использовать чреспищеводную учащающую электростимуляцию предсердий или в/в введение прокаинамида в сочетании с пропранололом, амиодарона или ибутилида [15, 16].
В случае приступа фибрилляции предсердий (ФП), которая в педиатрической практике встречается гораздо реже трепетания,очень важным является установление длительности аритмии. При давности ФП менее 48 часов и нестабильной гемодинамике показанасинхронизированная электрическая кардиоверсия. При стабильном состоянии, обычно у подростков, используют внутрь или в/в препараты IА (хинидин 10-12 мг/кг/сут, но не более 1 г/сут в 6-8 приемов через 1-2 часа или новокаинамид) и IС (пропафенон 10-15 мг/кг) класса, которые назначают только после предварительного урежения ЧСС (до 80-100 уд/мин) β-блокаторами (при симпатикозависимой форме ФП), антагонистами кальция (при вагозависимой форме) или дигоксином (у детей с врожденными, в т.ч. корригированными, и приобретенными пороками сердца). Последние 2 препарата противопоказаны при мерцательной аритмии у больных с синдромом WPW. В качестве препарата 2 ряда возможно сразу использование амиодарона. При длительности ФП более 48 часов высок риск тромбоэмболических осложнений. Поэтому перед купированием приступа необходимо провести эхокардиографию (предпочтительно чреспищеводную) для выявления тромбов в полостях сердца и только при их отсутствии приступать к фармакологической или электрической кардиоверсии. При наличии тромбов назначают антикоагулянты прямого действия (гепарин, фраксипарин) под контролем времени свертывания до получения эффекта и параллельно при тахисистолической форме ФП — препараты, замедляющие АВ проводимость: верапамил, дигоксин, пропранолол или кордарон. И только потом решают вопрос о целесообразности восстановления синусового ритма препаратами IА и IС класса. В ургентных случаях даже при длительном пароксизме ФП проводят кардиоверсию после предварительной нагрузки гепарином [8].
Выявленная на ЭКГ во время приступа тахикардия с широким QRS-комплексом не всегда позволяет определить, что это — ЖТ или СВПТ с абберацией проведения или блокадой ножек пучка Гиса [11]. Если форма аритмии точно не установлена, лечение проводят как при ЖТ, но начинают купирование пароксизма следует с дачи увлажненного кислорода (у детей раннего возраста) и в/в введения АТФ [6, 8]. При этом в случае истинной СВПТ (антидромной тахикардии при синдроме WPW, тахикардии по тракту Махайма или абберации по ножкам пучка Гиса) может произойти купирование приступа, а при ЖТ — восстановления синусового ритма не происходит (за исключением тахикардии из выводного отдела правого желудочка, которая высокочувствительна к аденозину) [17]. В отечественных руководствах препаратом первого ряда для купирования ЖТ считается лидокаин [1, 4, 11], хотя его применение основано больше на рекомендациях терапевтов по устранению желудочковых тахиаритмий ишемического генеза и не подтверждено в педиатрии. Лидокан вводится в/в, медленно, на 5%-ном р-ре глюкозы, в начальной дозе 1-2 мг/кг с переходом на поддерживающую — 0,5-1 мг/кг/час. По нашему мнению, в качестве препаратов первого ряда при ЖТ следует использовать прокаинамид, амиодарон, гилуритмал, соталол, пропафенон (ритмонорм) или флекаинид. К сожалению, в форме для парентерального введения в России присутствуют лишь первые 2 препарата. Дети с гемодинамически нестабильной ЖТ и фибрилляцией желудочков нуждаются в проведении сердечно-легочной реанимации (СЛР) по общим принципам (уложить ребенка на твердую поверхность, выдвинуть нижнюю челюсть больного, обеспечить проходимость дыхательных путей, провести прекордиальный удар и начать непрямой массаж сердца и искусственную вентиляцию легких) и электрической кардиоверсии с начальной мощностью разряда 2 Дж/кг. В отсутствии эффекта мощность увеличивается до 4 Дж/кг. Эффективность кардиоверсии повышается при введении лидокаина (в/в медленно 1 мг/кг каждые 5 мин., максимально 3 введения или капельно 20-50 мкг/кг/мин.) или амиодарона (в/в медленно 5 мг/кг за 20 мин., а затем капельно в той же дозе в течение 4-6 ч.) и натрия гидрокарбоната (7,5%-ный р-р 1 мл/кг, повторить через 10 мин).
При тахикарии типа «пируэт» у больных с синдромом удлиненного интервала QT (СУИОТ) препаратами выбора являются магния сульфат (в/в медленно 25-50 мг/кг в виде 12,5%-ного р-ра, но не более 2 г) и пропранолол (в/в медленно в разовой дозе 0,05-0,1 мг/кг или 0,1 мл 0,1% р-ра на год жизни, но не более 5 мл). В случае отсутствия сознания и пульса на периферических артериях, проводят СЛР и кардиоверсию (в сочетании с в/в ведением адреналина и/или лидокаина). Для купирования приступа ЖТ из выводного отдела левого желудочка эффективен верапамил, а при катехоламинергической полиморфоной двунаправленной ЖТ — пропранолол или эсмолол [5, 8, 11, 17].
Неотложная помощь при брадикардии требуется в случае развития клинической симптоматики: слабости, головокружений, потери сознания, асистолии или электромеханической диссоциации (наличие на ЭКГ синусовой брадикардии при отсутствии пульсовой волны). При этом, по мнению ведущих детских кардиологов [2, 4-6, 8], комплекс лечебных мероприятий не зависит от причины брадикардии и включает:
— ингаляцию увлажненного кислорода;
— атропин с целью уменьшения влияния блуждающего нерва на автоматизм водителей ритма. Препарат вводят внутривенно в виде (при подкожном введении в первой фазе действия препарата возможно усиление брадикардии) в дозе 0,02 мг/кг, но не более 0,5 мл 0,1%-ного р-ра у детей младшего возраста и 1,0 мл у подростков. Введение можно повторять каждые 5 мин. до общей дозы 1,5-2,5 мл в зависимости от возраста;
— изадрин 5-7,5 мг под язык или изопротеринол (изупрел) в/в капельно 0,025-10 мкг/ кг/мин или струйно медленно 0,5-2,0 мл 0,02%-ного р-рана 20 мл физраствора под контролем ЧСС. В отсутствии β-агонистов допустимо использование адреналина. При некритической брадикардии используют небольшие дозы препарата (в/в 0,01 мг/кг или 0,2-0,5 мл 0,1%-ного р-ра), при неэффективности или развитии остановки сердца вводят более высокие дозы (0,1-0,2 мг/кг), которые можно применять повторно, в т.ч. внутрисердечно, каждые 3-5 мин.;
— при развитии гипотензии — допамин в виде в/в инфузии со скоростью от 3 до 10 мкг/кг/мин, увеличивая постепенно до достижения приемлемых величин ЧСС и АД;
— при критической брадикардии (снижении ЧСС для новорожденных и детей 1 года — менее 60-65 уд/мин, для детей 2-6 лет — 55-60 уд/мин, 7-11 лет — 45-50 уд/мин, подростков 12-18 лет — 35-40 уд/мин, спортсменов — менее 30 уд/мин) в сочетании с нарушением сознания до введения лекарственных препаратов и восстановления адекватной ЧСС пациенту проводится непрямой массаж сердца;
— установку системы временной (чрескожной, эндрокардиальной), а в отсутствие устранимой причины брадикардии — постоянной электрокардиостимуляции ЭКС [18, 19].
Хроническая фармакотерапия аритмий основана на признании того факта, что в большинстве случаев аритмия не самостоятельное заболевание, а синдром, нередко ведущий или вообще единственный, осложняющий течение различных заболеваний сердечно-сосудистой и других систем; комплексная фармакотерапия должна обязательно включать лечение основного заболевания и устранение факторов, способствующих возникновению и поддержанию аритмии (электролитный, вегетативный дисбаланс, анемия, интоксикация). В ряде случаев это может способствовать самостоятельному восстановлению синусового ритма, а если этого не происходит, назначаются средства патогенетического и симптоматического действия. Принимая во внимание важную роль дисфункции вегетативной и центральной нервной системы в патогенезе аритмий у детей и подростков, сотрудниками Московского НИИ педиатрии и детской хирургии обосновано использование так называемой «базисной нейро-метаболической терапии», подразумевающей назначение препаратов, нормализующих кардио-церебральные взаимоотношения, вегетативный контроль ритма сердца и обменные процессы в кардиомиоцитах. С этой целью назначают ноотропные, сосудистые, вегетотропные и метаболические препараты [4, 11, 20]. Препараты назначают в комплексе (по одному из каждой группы), курсами по 1-2 мес., последовательно чередуя средства каждой группы между собой. При этом одновременно используют не более трех-четырех препаратов. Ноотропы наряду с кардиотрофиками составляют основу нейро-метаболической терапии. При этом следует помнить, что ноотропы (особенно ГАМК-эргические) оказывают прямое мебраностабилизирующее и антиаритмическое действие [5, 21], а также модулируют активность высших вегетативных центров, проявляя стимулирующее действие — пирацетам (ноотропил) 20-50 мг/кг/сут в 2-3 приема, глютаминовая кислота 0,25-3 г/сут в 3 приема, церебролизин по 1,0-4,0 в/м или в/в №10-20 или седативный эффект действие — фенибут 0,15-1 г/сут в 3 приема, пикамилон 0,04-0,1 г/сут в 3 приема, глицин — по 0,05-0,2 г 3-4 раза в день под язык. Некоторые препараты могут применяться независимо от исходного вегетативного тонуса: пиритинол (пиридитол, энцефабол) 0,05-0,3 г/сут в 2-3 приема, γ-аминомасляная кислота (аминалон) 1-3 г/сут в 3 приема, гопантеновая кислота (пантогам) по 0,25-1,0 3 раза в день и кортексин по 1,0-3,0 в/м или в/в № 10-15, а также транквилизатор грандаксин по 0,05-0,1 г 2-3раза в день. Среди лекарственных средств метаболического и антиоксидантного действия следует отметить L-карнитин (элькар, карнитор), препараты янтарной кислоты (янтовит, лимонтар), милдронат, инозин (рибоксин), триметазидин (предуктал), гипоксен, ксидифон. Не утратили своей актуальности кокарбоксилаза, витамин В15, рибофлавин, липоевая кислота. В течение более чем 20 лет мы изучаем эффективность препаратов метаболического типа действия в лечении аритмий. Мы имеем собственный опыт использования данных средств, а также цитохрома С, димефосфона, водорастворимой формы коэнзима Q (кудесана), креатинфосфата (неотона), препаратов нативной ДНК (дерината), водорастворимых антиоксидантов 3-оксипиридинового ряда (эмоксипина) и их сукцинат-содержащих аналогов (мексикора, мексидола) а также целого ряда соединений, не получивших пока статуса лекарственных средств [22]. Некоторые из метаболических средств обладают непосредственным мембраностабилизирующим и противоаритмическим действием (цитохром С, димефосфон, креатинфосфат), ряд препаратов оказывают влияние на вегетативную, в т.ч. автономную нервную систему (мексикор, димефосфон, элькар), а также проявляют анксиолитический (мексикор), ноотропный (мексикор, эмоксипин, димефосфон), противовоспалительный (димефосфон), иммунотропный (деринат, мексикор, димефосфон), противоишемический (предуктал, мексикор, цитохром С, креатинфосфат, элькар) и другие положительные эффекты. По нашему опыту, препараты данной группы особенно эффективны в лечении брадиаритмий и остро возникших желудочковых аритмий в комплексе с классическими антиаритмиками, что позволяет повысить эффективность и безопасность их использования [22]. В терапии нарушений ритма сердца традиционно широко применяются препараты магния (магнерот, кормагнезин, панангин, магнеВ6) и калия (глюкозо-инсулино-калиевая смесь, калия хлорид, панангин) [11]. Следует сказать, что целесообразность «метаболической поддержки» миокарда до настоящего времени дискутируется, поскольку, несмотря на многочисленные экспериментальные данные и мнение экспертов, эффективность метаболической терапии не подтверждена крупными рандомизированными исследованиями с оценкой влияния на «конечные точки» (смертность, частоту госпитализаций и т.д.). Существенный вклад в поддержку подобного подхода внесли недавно полученные в крупных трайлах результаты о противоаритмической активности ω-полиненасыщенных жирных кислот (омакор) [23]. С учетом состояния центральной и вегетативной нервной систем у конкретного пациента, нейро-метаболическая схема может дополняться адаптогенами, анксиолитиками, седативными и другими средствами. В ряде случаев в детском возрасте приходится прибегать к назначению классических противоаритмических средств, блокирующих ионные каналы кардиомиоцитов и непосредственно подавляющих электрофизиологический механизм запуска и поддержания аритмии. Их применение достаточно эффективно (50-80%), но сопряжено с рядом серьезных побочных эффектов со стороны сердечно-сосудистой (подавление автоматизма синусового узла, замедление АВ и внутрижелудочковой проводимости, гипотензия) и других систем (таблица 1).
Таблица 1.