Реферат
Электрохимические методы
Подготовила
студентка группы №205
медико-диагностического факультета
Астапович О.А
Проверил:
Кузнецов Борис Куприянович
Гомель 2020
Содержание
1. Введение (стр.3)
2. Классификация электрохимических методов (стр.3 - 4)
3. Приборы (стр.4 – 5)
4. Потенциометрический метод анализа (стр.6 - 8)
5. Кулонометрия (стр.8 - 11)
6. Литература (стр.12)
Введение
Электрохимические методы анализа - это совокупность методов качественного и количественного анализа, основанных на использовании электрохимических процессов, происходящих в электролитической ячейке (гальваническом элементе).
Электрохимические методы анализа основаны на использовании зависимости электрических параметров от концентрации, природы и структуры вещества, участвующего в электродной реакции или в электрохимическом процессе переноса зарядов между электродами.
Электрические параметры (сила тока, напряжение, сопротивление) могут служить аналитическими сигналами, если они измерены с достаточной точностью. Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости "аналитический сигнал-состав", либо для индикации конечной точки титрования в титриметрии. Электрохимические методы анализа позволяют определять концентрацию вещества в широком интервале с достаточной точностью и воспроизводимостью, могут быть легко автоматизированы и использованы в автоматических производственных циклах.
Классификация электрохимических методов
Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В общем случае различают две группы электрохимических методов:
- методы без наложения постороннего потенциала, основанные на измерении разности потенциалов, который возникает в электрохимической ячейке, состоящей из электрода и сосуда с исследуемым раствором. Эту группу методов называют потенциометрическими. В потенциометрических методах используют зависимость равновесного потенциала электродов от концентрации ионов, участвующих в электрохимической реакции на электродах.
- методы с наложением постороннего потенциала, основанные на измерении:
а) электрической проводимости растворов – кондуктометрия;
б) количества электричества, прошедшего через раствор – кулонометрия;
в) зависимости величины тока от приложенного потенциала – вольт-амперометрия;
г) времени, необходимого для прохождения электрохимической реакции – хроноэлектрохимические методы (хроновольтамперометрия, хронокондуктометрия). В методах этой группы на электроды электрохимической ячейки налагают посторонний потенциал.
По способу применения электрохимические методы можно классифицировать на прямые, в которых концентрацию веществ измеряют по показанию прибора, и электрохимическое титрование, где индикацию точки эквивалентности фиксируют с помощью электрохимических измерений. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т.д.
Приборы
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент, в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке типа гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации вещества, и электрод с постоянным потенциалом – электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами – потенциометрами.
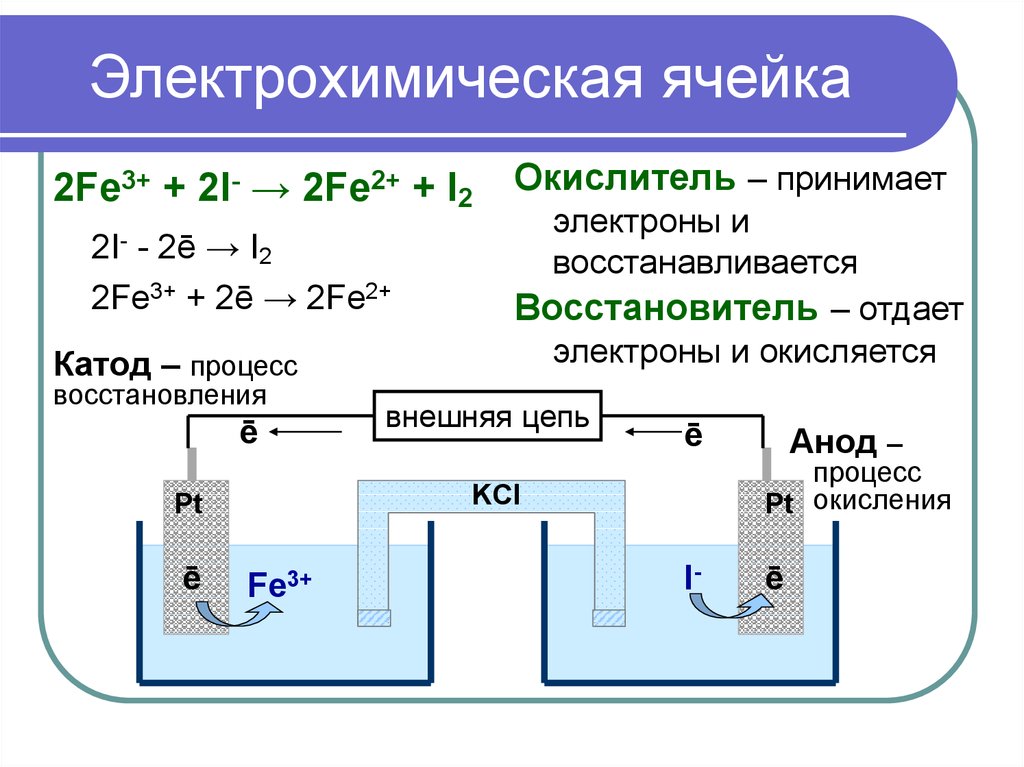
В методах с наложением постороннего потенциала применяют электрохимическую ячейку, названную так потому, что на электродах ячейки под действием наложенного потенциала происходит электролиз – окисление или восстановление вещества. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора.
Приборы для электрохимических определений кроме электрохимической ячейки, мешалки, нагрузочного сопротивления включают устройства для измерения разности потенциалов, тока, сопротивление раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр или микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал от ячейки очень слабый, то его усиливают с помощью радиотехнических усилителей. В приборах методов с наложением постороннего потенциала важной частью являются устройства для подачи на ячейку соответствующего потенциала стабилизированного постоянного или переменного тока (зависит от типа метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
Потенциометрический метод анализа
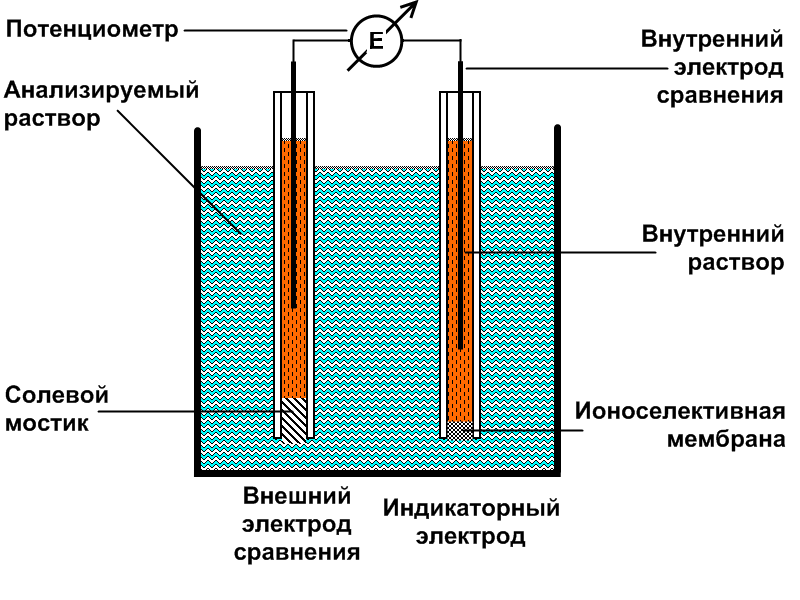
Потенциометрический метод анализа – один из старейших электрохимических методов. В начале 20 столетия он широко использовался для определения рН растворов, определения ряда катионов (серебро, медь, никель и др.), анионов (хлор, бром, сероводород и т.д.), а также ряда органических веществ. Однако, к 30-м годам нашего столетия потенциометрический метод в значительной степени был вытеснен другими электрохимическими и оптическими методами анализа.. Значительные трудности возникали из-за необходимости подбора специфических для каждого определения реакций. До последнего времени потенциометрический метод использовался в основном для быстрых обратимых реакций. Необратимые реакции, которые очень часто встречаются в аналитической химии, не могли быть использованы для этого метода, что также снижало его возможности.
Предложенное в начале нашего века потенциометрическое титрование с поляризованными электродами долгое время находило ограниченное применение из-за недостаточно разработанной теории, отличающейся от теории классического потенциометрического титрования с неполяризованными электродами.
Только с 50-х годов 20 столетия потенциометрический метод на базе использования поляризованных электродов вступает в новую фазу развития. Создается теория титрования с поляризованными электродами. В настоящее время этот метод нашел широкое применение для определения неорганических и органических веществ. Преимуществом метода является возможность более четко определить эквивалентную точку титрования.
Потенциометрическое титрование позволяет решать как аналитические задачи – определение концентрации веществ, так и физико-химические – определение произведений растворимости, констант устойчивости, протолитической диссоциации.
Основоположником потенциометрии является В. Нернст, получивший в 1889 году знаменитое уравнение для равновесных электродных потенциалов: E=E0 + S lg(a). В данном уравнении а - активность анализируемых ионов в растворе, S - крутизна электродной функции (2.3 RT/nF).
Позже, спустя почти целый век, в 1893 г. Р. Беренд осуществил первое потенциометрическое титрование. Сферы применения потенциометрии разнообразны. Сегодня потенциометрия применяется в аналитической и физической химии.
Потенциометрическое титрование широко используется в лабораторной практике. Оно применяется в тех случаях, когда надо провести экспресс-анализ вещества, а необходимых реактивов и оборудования нет или оно недостижимо в данное время. Создание новых моделей рН-метров, более компактных, надежных и удобных только повышает его востребованность.
Метод потенциометрического титрования отличается высокой точностью и чуткостью, с его помощью можно производить анализы в более разбавленных растворах, чем в растворах с использование индикаторов.
Потенциометрический анализ дает возможность выявлять в растворе концентрации нескольких веществ в одном растворе без их предварительного разделения, а также производить титрование мутных и цветных растворов.
Использование неводных растворителей дает возможность проводить анализ веществ, которые разлагаются водой, или нестойки в ней, или нерастворимы в воде. Например, определение содержания хлороводородной и монохлоруксусной кислот в смеси титрованием водного раствора является сложной задачей в связи с трудностью обнаружения двух скачков титрования. При титровании в ацетоне оба скачка выражены достаточно четко и содержание каждой кислоты в смеси может быть рассчитано. Используя необходимый растворитель можно изменить силу электролита и найти содержание компонентов, которые в водном растворе отдельно не титруются.
К недостаткам потенциометрического метода можно отнести то, что потенциал индикаторного электрода не всегда устанавливается быстро после добавления титранта и во многих случаях во время титрования надо производить большое количество отсчетов.
Но возможность провести быстрое выявлений концентрации вещества перевешивает недостатки потенциометрического титрования, и этот метод занял свое место и лабораторной практике.
Кулонометрия

Кулонометрию часто используют для определения многих металлов, неорганических соединений и неорганических газов. Кулонометрический анализ восходит к М.Фарадею, но практически он был впервые применен лишь в 1938 г. для определения тяжелых металлов пищевых продуктах. Особенно успешно реализован метод кулонометрии в различного рода газоанализаторах, позволяющих быстро определять в атмосфере, воздухе рабочей зоны, промышленных выбросах, автомобильных выхлопах и др. целый ряд важных приоритетных загрязнений (галогены, озон, оксиды серы и углерода, сероводород и др.) Кулонометрический анализ газов основан на измерении токов электродной реакции, в которую вступает определяемое вещество, являющееся деполяризатором, непрерывно подаваемое в электролитическую ячейку с потоком анализируемого газа. В соответствии с характером протекающей на электроде реакции кулонометрический метод может быть использоваться для определения восстановителей и окислителей. В отличие от других электрохимических методов (кондуктометрии, потенциометрии) в кулонометрическом анализе ток определяется лишь количеством электрохимически активного вещества, подаваемого в электролитическую ячейку, и мало зависит от факторов, обычно влияющих на результаты измерений другими методами: температуры, состояния поверхности электродов, интенсивности перемешивания и др.
Кулонометрическое титрование обычно проводят при постоянном токе. Титрант образуется в результате электрохимических процессов на рабочем электроде в сосуде для титрования. Число молей анализируемого вещества равно произведению силы тока на время, необходимое для образования титранта в количестве, достаточном для достижения конечной точки титрования с учетом стехиометрии. Химические стандарты не требуются. К титрантам, которые образуются в ходе электрохимических процессов, относятся H+, OH-, Br2 и I2.
Кулонометрия - единственный физико-химический метод анализа, в котором не требуются стандартные образцы.
Различают два основных вида кулонометрических определений: прямую кулонометрию и кулонометрическое титрование. В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению в кулонометрической ячейке. В методе кулонометрического титрования определяемое вещество реагирует с титрантом, который получается в кулонометрической ячейке при электролизе специально подобранного раствора.
Очень интересен метод, получивший название кулонометрического титрования. От титрования в обычном понимании этого слова этот метод отличается тем, что здесь производится электролитическое генерирование титранта, причём в подавляющем большинстве случаев непосредственно в том же растворе, в котором находится и определяемое вещество. Электрогенерированный реагент вступает во взаимодействие с определяемым веществом и появление малейшего избытка его, свидетельствующего о конце титрования, мгновенно фиксируется специально предусмотренной для этого индикаторной системой. Необходимо, чтобы титрующее вещество реагировало с определяемым быстро и количественно, не взаимодействуя ни с каким другим из имеющихся в данной пробе.
В кулонометрическом титровании применяются различные способы определения эквивалентной точки. Могут быть применены и те же, что и в обычном титровании (например, цветные индикаторы). Однако высокая чувствительность и точность этих методов обусловливает применение и более чувствительных способов индикации, обеспечиваемых инструментальными методами анализа: амперометрией, потенциометрией, спектрофотомерией, фотоэлектроколориметрией.
В кулонометрическом титровании используются химические реакции различных типов: кислотно-основные, окислительно-восстановительные, комплексообразования и др.
Преимущества кулонометрического титрования:
- не требует предварительного приготовления, стандартизации и хранения титрантов;
- титрант генерируется электрохимически непосредственно в присутствии анализируемого вещества и в количестве, необходимом только для данного титрования;
- легкая автоматизация процесса кулонометрического титрования
- высокая чувствительность и точность 0,1-0,05%;
- концентрация определяемых веществ в растворе до 10-6 моль/л.
Области применения кулонометрии
Кулонометрию применяют для определения как следовых, так и весьма больших количеств веществ с высокой точностью. Погрешность прямой кулонометрии в потенциостатическом режиме обычно 0,5-1%, а кулонометрического титрования в гальваностатическом режиме - 0,1-0,3%. Особенно точен дифференциальный вариант кулонометрии. Чувствительность кулонометрических методов определяется в основном способами установления момента завершения электрохимической или химической реакции и составляет 10-8-10-9 моль/л. Использование неводных и водно-органических сред расширяет область потенциалов, в которой протекают электрохимические и химические реакции, и таким образом увеличивает круг веществ, анализируемых кулонометрически. Кулонометрию применяют для анализа многих неорганических (практически все металлы, галогены, S и др.) и органических веществ(ароматические амины, нитро- и нитрозоcоединения, фенолы, азокрасители, алифатич. амиды и др.); определения воды в органических веществах; установления толщины и анализа металлических покрытий; изучения процессов коррозии; исследования кинетики и механизма химических реакций (в т.ч. каталитических); определения констант равновесия реакций; установления числа электронов, участвующих в электрохимических и химических взаимодействиях. Кулонометрические детекторы широко используются в проточно-инжeкционном анализе и хроматографии.
Литература
1.Аналитическая химия: Учебник / Под ред. Ищенко А.А.. - М.: Academia, 2017. - 512 c.
2. Голиков Г.А. Руководство по физической химии: Учебное пособие для химико-технологических специализированных вузов. Москва: Высшая школа. 2008. 383 с.
3. Общая химия. Учебник / Под ред. Дунаева С.Ф.. - М.: Academia, 2017. - 160 c.
4. Общая и неорганическая химия: учебное пособие / Под ред. Денисова В.В., Таланова В.М.. - Рн/Д: Феникс, 2018. - 144 c.