Составьте конспект лекции.
2. Выполненное задания присылать в личном сообщении ВК в виде фото или скринов (не перевернутые). Под своим именем.
Срок сдачи: до 16-00 27.09.2021г.
Обратите внимание: Не нужно переписывать лекцию дословно!!!!
Ваша задача: составить конспект таким, каким вам он будет понятен и доступен для изучения предложенной темы.
Важнейшие соединения хлора
Cl2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (~ 6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Основаны на процессе окисления анионов Cl-
2Cl-- 2e- = Cl20
Электролиз водных растворов хлоридов, чаще - NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
|
|
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 - гипохлориты; КClO3 - хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
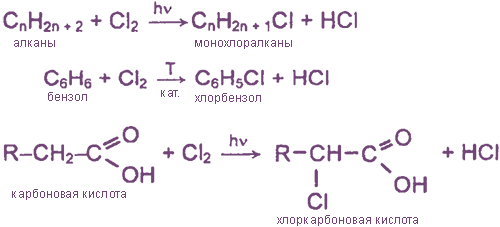
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
|
|
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl-- 2e- = Cl20
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:
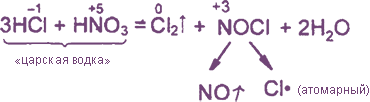
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Кислородсодержащие соединения хлора - чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
|
|

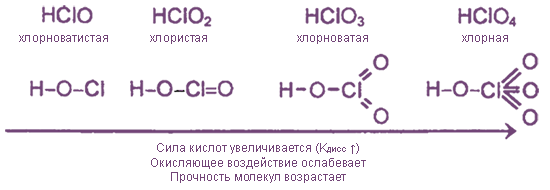
| гипохлориты | хлориты | хлораты | перхлораты |
| NaClO KClO Ca(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова соль Mg(ClO3)2 | KClO4 NaClO4 NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
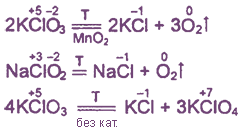
Хлорная (белильная) известь - смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:
