Этиленгликоль
Этиленгликоль(тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
Получение этиленгликоля
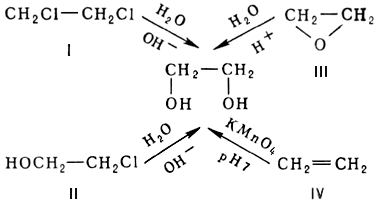
В промышленности этиленгликоль получают путём:
- (I) гидратацией 1,2-дихлорэтана;
- (II) гидратацией хлоргидринов;
- (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
- (IV) окислением этилена перманганатом калия:
Химические свойства этиленгликоля
Этиленгликоль обладает всеми свойствами гликолей.
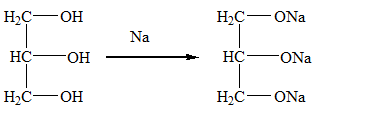
1. Взаимодействие с щелочными металлами: образует соли гликоляты
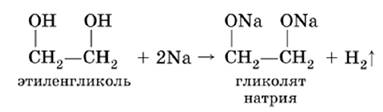
В отличие от одноатомных спиртов, многоатомные взаимодействуют также и с основаниями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета.
|
|
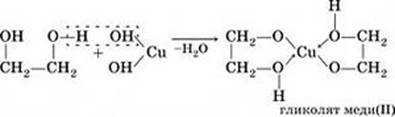
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину)
3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
аHOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O
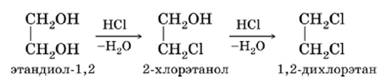
4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид
HOCH2CH2OH→t,H2SO4CH3COH+H2O
,
5. Окисление в зависимости от условий и окислителя: могут образовываться
- гликолевый альдегид HOCH2CHO,
- гликолевая кислота HOCH2COOH,
- глиоксаль OHCCHO,
- глиоксалевая OHCCOOH и щавелевая HOOCCOOH кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин (тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
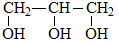
Трехатомный спирт, входящий в состав сложных эфиров природного происхождения - жидких и твердых жиров.
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
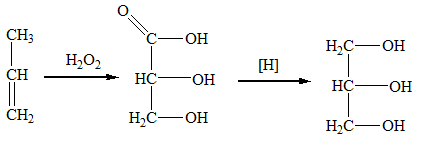
Химические свойства глицерина
Кислотные свойства, то есть способность отщеплять протон H+, у глицерина выражены сильнее, чем у одно- и двух атомных спиртов. Поэтому глицерин достаточно легко вступает в химическое взаимодействие с щелочными металлами и щелочами, образуя соли - глицераты (подобно этиленгликолю и этиловому спирту):
|
|
1. С активными металлами