Куприянова Татьяна
Лабораторный отчет
Практикум по экспрессии, выделению и очистке рекомбинантных белков.
Биоинформатический анализ белка His6-ZZ-GFP
Биоинформатический анализ показал, что белок GFP (greenfluorescentprotein) соединён с шестью остатками гистидина (His-тэг) и содержит сайт для гидролиза TEV-протеазой, что показано на рисунке 1.
Предсказанные физико-химические свойства составили:
· MW (целый белок) = 30241.13
· MW (GFP) = 26798.28
· PI (целый белок) = 5.90
· PI (GFP) = 5.59
M K H HHHHHP M S D Y D I P T TE N L Y F QG A M G K V S K G E E L F T G V V P I L V E L D G D V N G H K F S V S G E G E G D A T Y G K L T L K F I C T T G K L P V P W P T L V T T F G Y G L Q C F A R Y P D H M K Q H D F F K S A M P E G Y V Q E R T I F F K D D G N Y K T R A E V K F E G D T L V N R I E L K G I D F K E D G N I L G H K L E Y N Y N S H N V Y I M A D K Q K N G I K V N F K I R H N I E D G S V Q L A D H Y Q Q N T P I G D G P V L L P D N H Y L S T Q S A L S K D P N E K R D H M V L L E F V T A A G I T L G M D E L Y K
Рис.1 Структура целевого белка. Зеленым цветом выделен His-тэг, бордовым – сайт для гидролиза TEV-протеазой, бирюзовым – GFP.
Получение и культивирование продуцента
1. Смешали в эпендорфе 40мкл компетентных клеток штамма BL21(DE3)pLysSи 1мкл плазмид pet_ZZ_1A. Оставили инкубироваться на 35 минут.
2. Поставили эпендорф в термостат на 1 мин при 42℃, затем на лед на 2 мин.
3. Добавили 500мкл среды LB, поставили клетки в термостат на 40 мин при 37℃.
4. Отцентрифугировали клетки при 2500 об/мин 4 мин на центрифуге Eppendorfcentrifuge 54/15.
5. Слили надосадок, оставив ≈ 50 мкл
6. Пропипетировали и посеяли 30 мкл клеток на половину чашки с антибиотиками в концентрации:канамицин 100мкг/мл и хлорамфеникол 25мкг/мл.
7. На вторую половину посеяли 10мкл нетрансформированных клеток для контроля.
8. Оставили в инкубаторе при 37℃.
9. Выбрали 1 колонию, пересадили ее в 3 мл среды LB и культивировали в течение ночи при 30℃.
10. На следующий день развели 200 мкл суспензии до 2 мл и измерили OD600=1,9
11. Добавили недостающие компоненты к среде TBиз расчета на 50 мл вобъемах, указанных в таблице 1.
| Соединение | Исходная концентрация | Конечная концентрация | Объем, мкл |
| Канамицин | 100 мг/мл | 0,05 мг/мл | |
| Хлорамфеникол | 25 мг/мл | 0,025 мг/мл | |
| Глюкоза | 2М | 0.5% | |
| Клеточная суспензия | 1,9 опт.ед | 0,08 опт.ед |
Таблица 1.
12. Поставили колбы на качалки на 2 ч.
13. После культивирования измерили оптическую плотность, OD=0,68.
14. Добавили 25мкл IPTG (сток 1М), получив конечную концентрацию 0,5mM.
15. Культивировали еще 3 часа
16. Финальная OD = 1.71
17. Отцентрифугировали клетки при 4000g 10мин, слили супернатант, оставили храниться при -20℃.
Выделение белка His6-ZZ-GFP
1. Приготовили буфер из стоковых растворов из расчета на 40 мл, согласно таблице 2.
| Соединение | Исходная концентрация | Конечная концентрация | Объем, мл |
| TrisHCl (ph=8,0) | 1M | 50mM | |
| NaCl | 5M | 0,15M | 1,2 |
| Глицерин | 50% | 10% | |
| DTT | 1M | 1mM | 0,04 |
| Имидазол | 2М | 10mM | 0,2 |
Таблица2.
2. Добавили 5 мл буфера к клеткам, ресуспензировали.
3. Добавили 35мкл лизоцима в суспензию, оставили на 20 мин
4. Добавили 25 мкл MgCl2 и 50мкл DNAse, оставили на 5 мин.
5. Добавили 50 мкл PMSF (сток 100mM).
6. Разрушили клетки ультразвуком на приборе UP5OH (hielscher), параметры: cycle-1, %Amplitude– 100.
7. Отцентрифугировали при 4℃ - 30мин – 16000g.
8. Отобрали надосадок в новые эпендорфы, и оставили немного пеллета для электрофореза.
9. Хранили в морозильнике при -20℃.
Металлохеллатная хроматография
Хроматографическая очистка белка His6-ZZ-GFP производилась c применением сорбента Ni Sepharose 6 Fast Flow (GE Healthcare кат. Номер17531801).
1. Приготовили 200 мл буфера А согласно таблице 3.
| Соединение | Исходная концентрация | Конечная концентрация | Объем, мл |
| TrisHCl (ph=8,0) | 1M | 50mM | |
| NaCl | 5M | 0,5M | |
| Глицерин | 50% | 5% | |
| Имидазол | 2M | 10mM |
Таблица 3.
2. К 25 мл буфера добавили DTT (сток 1М) 25мкл и PMSF (сток 100mM) – 250мкл. Получили готовый буфер А.
3. Приготовили буфер B (0,1% Tween 20): 5мл буфера А + 50мкл Tween20 (сток 10%).
4. Буфер С (1М NaCl): 4,48 мл буфера А + 0,56 NaCl (сток 5М).
5. Буфер D (20mM имидазол): 5мл буфера А + 25мкл имидазола (сток 2М)
6. Буфер Е (250mM имидазол): 5мл буфера А + 625мкл имидазола (сток 2М).
7. В колонки на штативах перенесли 500мкл сорбента NiSepharose.
8. Промыли колонку от метанола dH20 – V=3cv.
9. Уровняли буфером А – V=4cv.
10. Внесли весь объем образца, собрали flowtrough.
11. Промыли по порядку буферами A,B,C,DV=4cv.
12. Внесли 500мкл элюирующего буфера E, собрали элюат. Повторили еще 4 раза.
13. Пробы хранили в морозильнике при -20℃.
Для визуализации результатов очистки проводили электрофорез SDS-PAGE 10% разделяющий и 5% концентрирующий гели. Использовалистандарты BSA (BioRad Protein™ unstained standarts #161-0317) и маркер (unstained protein marker 26610).Результаты очистки представлены на рисунке 2.
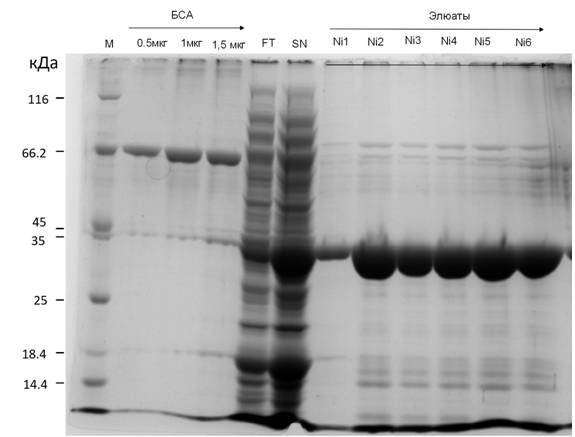
Рисунок 2. Рис. 2 Препараты His6-ZZ-GFP на различных этапах очистки (SDS-электрофорез в 10% ПААГ). M - маркеры молекулярных масс белков, SN - супернатант, FT - проскок, Ni 1-6 - элюаты после NiNTA сефарозы.
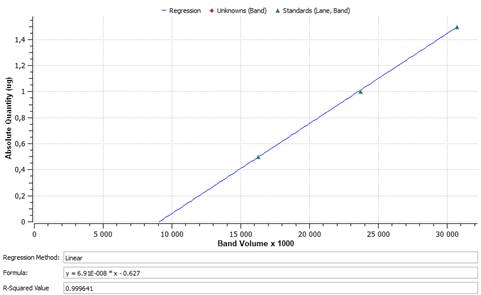
Рис.3 Калибровочная кривая для определения концентрации белка
Данные денситометрии представлены в таблице 3.
Таблица 3.
| Фракция | Объем фракции, мл | Концентрация белка мкг/мл *по денситометрии | Количество белка, мкг | Чистота фракции, % [band %] |
| FT | 154,9074 | 464,7222 | 23,7 | |
| SN | 210,8975 | 632,69 | 21,4 | |
| Ni1 | 0,25 | 184,9379 | 46,234 | |
| Ni2 | 0,25 | 550,4255 | 137,61 | 87,7 |
| Ni3 | 0,25 | 422,9113 | 105,73 | 92,2 |
| Ni4 | 0,25 | 451,4995 | 112,87 | 72,4 |
| Ni5 | 0,25 | 581,7455 | 145,44 | 68,5 |
| Ni6 | 0,25 | 474,4049 | 118,6 | 61,8 |
Гель фильтрация
Гель-фильтрация проводилась для очистки полученных белковых элюатов от имидазола для дальнейшего расщепления TEV-протеазой, с использованием колонки PD10 (GE Healthcare 52130800)
1. Приготовили буфер для гель согласно таблице 4 из расчета на 5 мл.
Таблица 4.
| Соединение | Исходная концентрация | Конечная концентрация | Объем, мл |
| TrisHCl (ph=8,0) | 1M | 50mM | 250мкл |
| EDTA | 0,5M | 0,5mM | 5мкл |
| DTT | 1M | 1mM | 5мкл |
2. Объединили элюаты (Ni1-Ni6) и довели до 2,5 мл dH20.
3. Закрепляем колонку на штативе и промываем буфером 5 раз по 4мл.
4. Наносим весь объем образца на колонку. Даем стечь буферу.
5. Затем наливаем 3,5 мл буфера и собираем элюат, выталкиваемый буфером.
6. Наносим 20 мл dH20 для очистки колонки.
7. Измерили концентрацию белка на приборе Nanodrop.
8. [C]=0,245 мг/мл
mбелка =0,245мг/мл*3,5 мл = 0,8575 мг
В ходе гель фильтрации получили 3,5 мл белка с концентрацией 0,245 мг/мл.