Влияние ротационного стресса на показатели иммунитета. Роль опиатных рецепторов. В большинстве опубликованных работ, посвященныхизучению влияния стресса на иммунный ответ, исследуются изменения системного иммунного ответа в условиях внутривенной или внутрибрюшинной иммунизации. Принимая во вниманиеразные компоненты внутрисистемной регуляции общих и локальных форм иммунного ответа, представлялось целесообразным исследование эффектов стресса и блокады опиатных рецепторов в условиях развития локальной формы иммунного ответа.
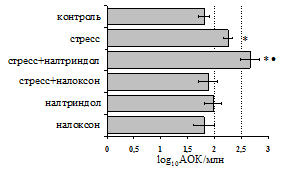
Как видно из рис. 1, в индуктивную фазу иммунного ответа на фоне стресса наблюдается увеличение числа АОК в лимфатическом узле (ЛУ) иусилениестепени выраженности реакции ГЗТ. Блокада δ-опиатных рецепторов приводит к ещё более выраженной активации антителогенеза, в то время как
АБ

ВГ

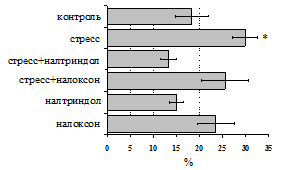
Рис. 1. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в индуктивную фазу иммунного ответа. Здесь и на рис. 2: * - p<0,05 к контролю; • - p<0,05 к стрессу.
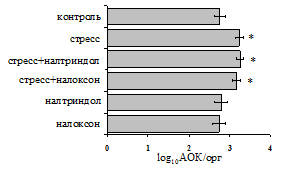
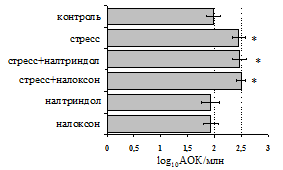
на фоне налоксона стимулирующий эффект ротационного стресса на антителогенез отменяется. Стрессиндуцированное усиление выраженности реакции ГЗТ отменяется как налоксоном, так и налтриндолом.Изолированное введение животным налтриндола или налоксона на количество АОК и степень выраженности ГЗТ влияния не оказывает. В эффекторную фазу иммунного ответаротационный стресс (рис. 2) стимулирует какклеточный, так и гуморальный ответ, однако, в отличие от индуктивной фазы, на фоне блокады опиатных рецепторов эффекты стресса не модифицируются. Таким образом, стимуляция опиатныхрецепторов в индуктивную фазу иммунного ответа играет важную роль в стрессиндуцированных измененияхиммуногенезаиответственназа активацию функций иммунной системы при стрессе.
Влияние гидрокортизона и адреналина на локальный иммунный ответ в условиях блокады опиатных рецепторов. Впроцессеразвитиястрессреакцииосновные стрессреализующие факторы глюкокортикоиды,
АБ
ВГ


Рис. 2. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в эффекторную фазу иммунного ответа.
Таблица 1. Влияние гидрокортизона в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел | ||
| ЯСК наорган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | |
| Интактные животные (контроль), n=19 | 8,93±1,35 | 2,15±0,15 | 3,01±0,17 |
| (142) | (1014) | ||
| Физиологический | 7,79±1,08 | 2,27±0,16 | 3,10±0,13 |
| раствор, n=16 | (186) | (1252) | |
| Гидрокортизон, n=19 | 4,98±0,68*# | 1,64±0,23 | 2,17±0,25*# |
| (43) | (149) | ||
| Гидрокортизон | 6,71±0,75a | 0,96±0,21*#a | 1,50±0,31*# |
| +Налоксон, n=15 | (9) | (32) | |
| Гидрокортизон | 5,87±0,71 | 0,55±0,14*#a | 1,07±0,22*#a |
| +налтриндол, n=17 | (4) | (12) | |
| Налоксон, n=10 | 7,76±1,27 | 2,24±0,08 | 3,07±0,14 |
| (173) | (1187) | ||
| Налтриндол, n=12 | 8,38±1,37 | 1,93±0,11 | 2,79±0,11 |
| (86) | (622) |
Примечание. Здесь и в табл. 2, 3, 4 в скобках указана средняя геометрическая числа АОК (антилогарифм из средней арифметической log10 числа АОК). * - p<0,05 к контролю; # - p<0,05 к физиологическому раствору; а - p<0,05 к гидрокортизону по непарному t-критерию Стъюдента..
катехоламины и эндогенные опиоиды находятся в тесной взаимосвязи и оказывают друг на друга взаимное регуляторное влияние (O`Connor, 2000). Как видно из табл. 1, в индуктивную фазу иммунного ответа гидрокортизон снижает количество ядросодержащих клеток в лимфатическом узле и абсолютное число АОК. Привведении гидрокортизона на фоне блокады опиатных рецепторов налоксоном и налтриндоломрегистрируется отмена индуцированного гидрокортизоном снижения количества ЯСКи ещёболеевыраженноеугнетениеантителогенезапоабсолютным и относительным показателям,
Таблица 2. Влияние адреналина в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел | |||
| ЯСК на орган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | ||
| Интактные животные (контроль) n=11 | 6,29±1,04 | 2,43±0,16 | 3,15±0,22 | |
| (268) | (1403) | |||
| Адреналин,n=9 | 5,71±0,74 | 2,07±0,14 | 2,79±0,16 | |
| (118) | (618) | |||
| Адреналин | 7,37±2,08 | 1,94±0,15* | 2,73±0,24 | |
| +Налоксон, n=6 | (86) | (541) | ||
| Адреналин | 6,62±1,30 | 1,78±0,25* | 2,45±0,32 | |
| +налтриндол, n=11 | (60) | (283) | ||
| Налоксон, n=10 | 7,76±1,27 | 2,24±0,08 | 3,07±0,14 | |
| (173) | (1187) | |||
| Налтриндол, n=9 | 8,07±1,82 | 2,08±1,97 | 2,90±0,13 | |
| (121) | (803) |
особенно ярко проявляющееся в условиях блокады d-рецепторов. Изолированное введение экспериментальным животным налтриндола и налоксона на исследуемые показатели влияния не оказывает. В эффекторную фазу иммунного ответа гидрокортизон угнетает количество ядросодержащих клеток в лимфатическом узле, абсолютное число АОК, однако в отличие от индуктивного периода на фоне блокады опиатных рецепторов эффекты гидрокортизона на показатели клеточности и антителогенеза не модифицируются.
Несколько иная картина наблюдается при анализе эффектов адреналина. Как видно из табл. 2, в индуктивную фазу адреналин оказываетстатистически достоверный эффект на антителогенез по относительным показателям (F=5,28; p<0,03), несмотря на то, что при межгрупповом сравнении по отношению к контролю угнетение относительного количества АОК имеет место только при комбинации адреналина с опиатными
Таблица 3. Влияние β-эндорфина на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле
| Экспериментальное воздействие (β-эндорфин) | Число живот-ных | Лимфатический узел | Интенсив-ностьГЗТ | ||
| ЯСК на орган (*106) | Log10 АОК на 106 ЯСК | Log10 АОК на Орган | ИР по массе стопы, %· | ||
| Контроль | 4,62±0,89 | 2,43±0,10 | 3,04±0,01 | 17,22±2,41 | |
| (271,28) | (1088,94) | ||||
| 100 мкг/кг | 4,33±0,71 | 1,98±0,22* | 2,57±0,26* | 19,84±3,68 | |
| (95,28) | (370,54) | ||||
| 10 мкг/кг | 5,25±0,70 | 2,06±0,26 | 2,76±0,25 | 23,92±3,46 | |
| (115,56) | (569,35) | ||||
| 1 мкг/кг | 4,87±1,06 | 2,46±0,18 | 3,05±0,16 | 20,25±4,25 | |
| (286,09) | (1128,59) | ||||
| 0,1 мкг/кг | 7,55±1,35 | 2,25±0,18 | 3,08±0,13 | 18,82±6,17 | |
| (117,27) | (1198,91) | ||||
| 0,01 мкг/кг | 5,33±1,13 | 2,68±0,09 | 3,34±0,13 | 26,72±3,88 | |
| (474,99) | (2192,95) | ||||
| 0,001 мкг/кг | 5,90±1,73 | 2,62±0,73 | 3,21±0,13 | 21,27±4,88 | |
| (421,49) | (1607,54) | ||||
| 0,0005 мкг/кг | 5,82±0,81 | 2,87±0,08* | 3,61±0,07* | 28,72±4,10 | |
| (743,72) | (4031,74) |
Примечание. Здесь и в табл. 4: · - индекс реакции (ИР): И.Р.=(Ро–Рк)/Рк·100%, где Ро и Рк - показатели массы в опытной и контрольной конечностях. * - p<0,05 к контролю по t-критерию Фишера наименьшей значимой разницы.
антагонистами. В эффекторную фазу иммунного ответа адреналин на антителогенез в лимфатическом узле не влияет. Таким образом, блокада опиатных рецепторов в индуктивную фазу иммунного ответа приводит к существенной модификации иммунорегуляторных эффектов глюкокортикоидов и катехоламинов, связанной с изменениями секреции β-эндорфина в ответ на введение гидрокортизона или адреналина (Mougeyetal., 1986; Bagdyetal., 1989; Goodwinetal., 1992).
Влияние β-эндорфина на показатели клеточного и гуморального иммунитета. Степень выраженности эффектов β-эндорфина в системе invivo
Таблица 4. Влияние β-эндорфина в условиях блокады опиатных рецепторов на число АОК, клеточность и выраженность реакции ГЗТв регионарном лимфатическом узле в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Чис-ло жи-во-тных | Лимфатический узел | Интенсив-ностьГЗТ | ||
| ЯСК на орган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | ИР по массе стопы, % | ||
| Контроль | 5,34±0,62 | 2,35±0,10 | 3,02±0,11 | 22,43±3,19 | |
| (223,55) | (1043,31) | ||||
| β-эндорфин | 4,71±0,51 | 1,99±0,14* | 2,36±0,15* | 22,16±2,73 | |
| (100 мкг/кг) | (98,80) | (423,03) | |||
| β-эндорфин | 5,98±0,66 | 2,67±0,07* | 3,40±0,08* | 27,95±2,73 | |
| (0,0005 мкг/кг) | (465,21) | (2519,33) | |||
| β-эндорфин | 5,64±0,97 | 2,21±0,14 | 2,87±0,18 | 23,79±4,27 | |
| (100 мкг/кг) + | (161,61) | (747,62) | |||
| налоксон | |||||
| β-эндорфин | 5,95±0,66 | 2,16±0,12 | 2,90±0,14 | 28,57±6,77 | |
| (0,0005 мкг/кг) + | (143,12) | (798,77) | |||
| налоксон | |||||
| β-эндорфин | 7,18±41,24 | 2,50±0,07 | 3,29±0,05* | 23,32±4,17 | |
| (100 мкг/кг) + | (314,71) | (1945,42) | |||
| налтриндол | |||||
| β-эндорфин | 9,07±1,24* | 2,52±0,09 | 3,43±0,12* | 25,67±3,12 | |
| (0,0005 мкг/кг) + | (327,67) | (2673,98) | |||
| налтриндол | |||||
| Налоксон | 6,40±0,73 | 2,23±0,09 | 3,01±0,11 | 16,08±2,02 | |
| (170,40) | (1013,98) | ||||
| Налтриндол | 6,98±0,55 | 2,04±0,24 | 2,87±0,21 | 18,36±1,92 | |
| (110,87) | (755,38) |
Примечание. * - p<0,05 к контролю по непарному t-критерию Стьюдента.
напрямую зависит от вводимой дозы пептида (табл. 3). Пептид оказывает разнонаправленный эффект на гуморальный иммунный ответ, угнетающий в дозе 100 мкг/кг истимулирующий в дозе 0,0005 мкг/кг образование АОК в регионарном ЛУ. При этом статистически достоверного влияния β-эндорфина на клеточность ЛУ и степень выраженности реакции ГЗТ не обнаруживается. Таким образом, β-эндорфин в системе invivo в зависимости от дозы как усиливает, так и угнетает образование антителопродуцентов.
Данные о влиянии β-эндорфина на фоне блокады опиатных рецепторов представлены в табл. 4. Блокада рецепторов неселективным антагонистом налоксоном отменяет как угнетающий эффект дозы 100 мкг/кг, так и стимулирующий эффект дозы 0,0005 мкг/кг на относительное и абсолютное количество АОК. В то же время введение мышам β-эндорфина на фоне блокадыδ-рецепторовналтриндоломпоабсолютнымпоказателямне отменяет стимулирующего эффекта низкой (0,0005 мкг/кг) дозы пептида и приводит к увеличение числа АОК в ответ на введение животным высокой дозы (100 мкг/кг). Кроме этого, введение пептида в дозе 0,0005 мкг/кг на фоне налтриндола приводит к статистически достоверному увеличению клеточностиЛУпосравнениюсконтролем.На степень выраженности иммунного воспаления комбинация β-эндорфина с антагонистами опиатных рецепторов влияния не оказывает. Таким образом, β-эндорфин в зависимости от дозы оказывает разнонаправленное влияние на образование антителопродуцентов, не влияя



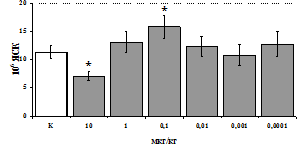
Рис. 3. Влияние DADLEна относительное и абсолютное число АОК, выраженность реакции ГЗТ и клеточность в регионарном лимфатическом узле в индуктивную фазу иммунного ответа.
* - p<0,05; ** - p<0,01; *** - p<0,001 к контролю по t-критерию Фишера наименьшей значимой разницы.
на клеточноопосредованный ответ. Способность пептида взаимодействовать с d-рецептором проявилась только при введениивысокой дозы, что, в свою, очередь указывает на возможность реализации через d-рецептор иммуносупрессивных эффектов, напротив блокада m-рецепторов отменяет эффекты пептида независимо от вводимой дозы. В эффекторную фазу влияния β-эндорфина на иммунный ответ не выявляется.
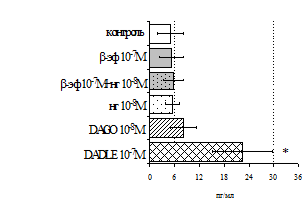
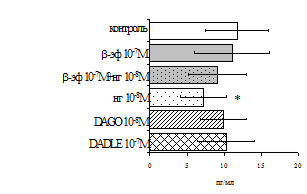
Параллельно нами изучалосьсравнительное влияние селективных m и d-агонистов на выраженность локального иммунного ответа. Как видно из рис. 3, в индуктивнуюфазуиммунного ответа введение d-агонистаDADLE в дозах 10,0; 0,1; 0,01 мкг/мл стимулирует количество АОК по абсолютным иотносительным параметрам, не влияет на степень выраженности иммунного воспаления (ГЗТ) и оказывает разнонаправленное действие на клеточность регионарного лимфатического узла, при этом в дозе 10 мкг/кг угнетая, а в дозе 0,1 мкг/кг - увеличивая содержание ЯСК. Введение m-агонистаDAGO статистически достоверно влияет только на относительное число АОК и клеточность регионарного лимфатического узла. В дозах 10,0; 1,0; 0,0001 мкг/кг пептид активирует образование антителопродуцентов по относительным показателям и в диапазоне доз 10-
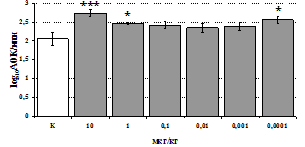
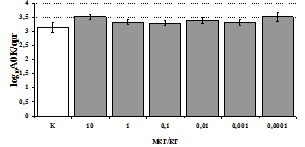


Рис. 4. Влияние DAGOна относительное и абсолютное число АОК,выраженность реакции ГЗТ и клеточность в регионарном лимфатическом узле в индуктивную фазу иммунного ответа.
* - p<0,05; ** - p<0,01; *** - p<0,001 к контролю по t-критерию Фишера наименьшей значимой разницы.
0.1 мкг/кг угнетает количество ЯСК (рис. 4). Таким образом, по нашим данным, в системеinvivo эффекты b-эндорфина и аналогов энкефалинов с m,d-селективным спектром связывания DAGO и DADLE значительно варьируют по направленности действия, эффективному диапазону доз,взаимодействию с опиатных рецепторов различных типов, а так жезависят от этапа, на котором конкретный опиоидный пептид вмешивается в развитие иммунных реакций. В то же время наиболее выраженное активирующее влияние наблюдается при введении экспериментальным животным селективного агониста d-рецепторовDADLE.
Влияние β-эндорфина, 88-91 фрагмента липотропина MPF,селективных лигангдов DAGO, DADLE на пролиферативный ответ лимфоцитов. Степень выраженности эффектов исследуемых опиоидных пептидов в системе invitroзависит от их концентрациииприсутствиямитогена в культуральной среде. Все лиганды опиатных рецепторов проявляют активность только на стимулированных митогеном культурах. Как видно из рис. 5,b-эндорфинв концентрации 10-7М статистически значимо усиливает пролиферативный ответ лимфоцитов в культурах с ФГА 5 мкг/мл. Внесение пептида в культуры
A 

Рис. 5. Влияние b-эндорфина (A) и DAGO (Б) на ФГА-индуцированный пролиферативный ответ лимфоцитов.
Здесь и на рис. 6: I - ФГА 5 мкг/мл, II - ФГА 2,5 мкг/мл, III - ФГА 1,25 мкг/мл, IV – без внесения ФГА.Число наблюдений в группах с b-эндорфином n=9, в группах с DAGO - n=8. * - р<0.05 к контролю по парному t-критерию Фишера наименьшей значимой разницы..
в концентрации 10-8М приводит к стимуляции реакции бласттрансформации в присутствии ФГА 2,5 мкг/мл. Низкие (10-10, 10-11М) концентрации b-эндорфинастимулируют пролиферативный ответ в культурах с ФГА 5,0 и 2,5 мкг/мл соответственно. Внесение b-эндорфина в концентрации 10-12М, отражающей фоновый уровень пептида в плазме крови, не оказывает существенного влияния на пролиферацию лимфоцитов. А.А. Зозулей и С.Ф. Пшеничкиным (1990) высказано предположение, что иммуномодулирующие эффекты b-эндорфина могут проявляться через С-концевойучасток пептидной цепи, невзаимодействующий с d-, m-рецепторами. В связи с этимпредставлял интерес анализ эффектов С-концевого тетрапептида b-эндорфина MPF (меланотропин-потенциирующего фактора) на пролиферативную активность лимфоцитов периферической крови. Как видно из рис. 6, MPF ни в однойиз исследуемыхконцентрацийстатистически значимых эффектов на спонтанную и индуцированную митогеном пролиферацию лимфоцитов неоказывает. Это позволяетпредположить,что выявленный стимулирующий эффект b-эндорфина на пролиферативную активность лимфоцитов не опосредуется через его С-концевой участок.
В связи с тем, чтоb-эндорфин N-концевой последовательностьюсвязывается как с m-, так и d-опиатнымирецепторами и не ясно, какой тип рецепторов в данном случае является основным проводником сигнала с поверхности клетки, мы сопоставили его эффекты на
A 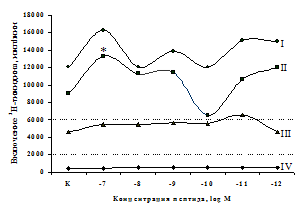

Рис. 6. Влияние DADLE (А) и MPF (Б) на ФГА-индуцированный пролиферативный ответ лимфоцитов.
Число наблюдений n=8. пролиферацию с эффектами селективных m- и d-агонистов. Данные о влиянии синтетического селективного агониста μ-опиатных рецепторов DAGO на пролиферативную активность лимфоцитов периферической крови представлены в рис. 5. Анализ зависимости эффектов от концентрации показал, что DAGO в высоких и низких концентрациях достоверно усиливает пролиферативный ответ лимфоцитов исключительно в присутствии субоптимальной концентрации (2,5 мкг/мл) митогена. На спонтанный пролиферативный ответ DAGO подобно b-эндорфину влияния не оказывает.
Аналогичные результаты получены при анализе влияния селективного d-агониста DADLE на пролиферациюлимфоцитов (см. рис. 6).Выявлено, что DADLEусиливает включение 3Н-тимидина лимфоцитами по сравнению с контролем в присутствии ФГА 2,5 мкг/мл и высокой концентрации (10-7 М) данного пептида.
В дальнейшем проводилась сравнительная оценка влияния β-эндорфина на пролиферативный ответ на фоне блокады опиатных рецепторов в нефракционированных и фракционированных, очищенных от моноцитов, лимфоцитарных культурах. Как видно из рис. 7, в нефракционированной лейкоцитарной суспензии стимулирующий эффект b-эндорфина на пролиферативный ответ не отменяется, а напротив, усиливается. При удалении моноцитов из фракции мононуклеаров b-эндорфин (F=13,07; p=0,006) и налоксон (F=10,21; p=0,011) оказываютвысокодостоверные


Рис. 7. Эффекты b-эндорфина на фоне блокады опиатных рецепторов, DAGO и DADLE на спонтанную (A) и индуцированную ФГА 2,5 мкг/мл (Б) пролиферативную активность лимфоцитов в нефракционированных клеточных культурах.
* - р<0,05 к контролю по парному t-критерию Стъюдента.
самостоятельныеэффектынаФГА-индуцированную пролиферацию, не проявляя статистически значимого взаимодействия между собой (F=4,08; p=0,074). Последующее сравнение средних величин показало, что направленность эффектовопиоидныхпептидовпротивоположнавлиянию, оказываемому b-эндорфином и налоксоном в присутствии фракции моноцитов (рис. 8). В частности,выраженноеугнетениепролиферациилимфоцитовкакпо сравнению с контролем, так и с b-эндорфином наблюдается при совместном внесении в культуры b-эндорфина и налоксона. Угнетающийэффектназахват 3Н-тимидина лимфоцитами оказывает селективный m-агонист DAGO. Селективный агонист d-рецепторов DADLE на ФГА-индуцированную пролиферативную активность лимфоцитарной фракции не влияет.При этом эффекты исследуемых опиоидов в аналогичных культурах без митогена не обнаруживаются. Проведенный корреляционный анализ выявил статистически достоверную (r=0,73; р<0,05) зависимость между интенсивностью пролиферации лимфоцитов в нефракционированных культурах под воздействием b-эндорфина и в аналогичных культурах, очищенных от фракции моноцитов.
Анализ роли d-рецепторов в регуляции пролиферативного ответа в нефракционированной лейкоцитарной суспензии и фракции лимфоцитов (рис. 9) показал отмену стимулирующего эффекта b-эндорфина налтриндолом во фракции лейкоцитов. Во фракции лимфоцитов b-эндорфин и налтриндол на степень выраженности пролиферации не влияют, что свидетельствует о возможной
АБ


Рис. 8. Эффекты b-эндорфина на фоне блокады опиатных рецепторов, DAGO и DADLE на спонтанную (A) и индуцированную ФГА 2,5 мкг/мл (Б) пролиферативную активность лимфоцитов в клеточных культурах, очищенных от фракции моноцитов.
* - р<0,05 к контролю по парному t-критерию Стъюдента.
АБ


Рис. 9. Эффекты b-эндорфина на фоне блокады d-опиатных рецепторовна индуцированную ФГА 2,5 мкг/мл пролиферативную активность лимфоцитов во фракции лейкоцитов (А) и фракции лимфоцитов (Б).
* - р<0,05 к контролю по парному t-критерию Стъюдента.
реализации стимулирующего эффекта пептида через d-рецептор, но только в присутствии моноцитов.
Учитывая важную регуляторную роль моноцитов, в дальнейшем мы попытались оценить роль IL-1b и продуктов циклооксигеназного цикла в b-эндорфинопосредованной регуляции пролиферативного ответа лимфоцитов в присутствии ФГА (рис. 10А). Все обследованные здоровые доноры были разделены по индивидуальной чувствительности к b-эндорфину на две группы: у 1-й группы пептид стимулировал
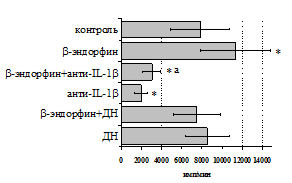

Рис. 10. Влияние b-эндорфина на ФГА-индуцированный пролиферативный ответ лимфоцитов в присутствии анти-IL-1b антител и на фоне блокады синтеза простагландинов ДН у доноров 1-й (А, n=9) и 2-й (Б, n=11)групп.
* - р<0,05 к контролю; а - р< 0,05 к анти-IL-1b по парному t-критерию Стъюдента.
пролиферативный ответ, а у 2-й – угнетал. В первой группе доноров на фоне моноклональных антител к IL-1b наблюдается резкое снижение пролиферативной активности, в то же время при внесении в культуры анти-IL-1b-антител в присутствии b-эндорфина наблюдается некоторое усиление пролиферативного ответа,достоверно отличающееся от культур с анти-IL-1b-антителами, но по сравнению с контролем уровень захвата метки был так же достоверно ниже. Как видно рис. 10Б, у второй группы доноров на фоне анти-IL-1b-антител интенсивность пролиферативного ответа в присутствии b-эндорфина не изменяется.
А


без ФГАФГА 2,5 мкг/мл
Б

без ФГАФГА 2,5 мкг/мл
Рис.11. Влияние b-эндорфина, DAGO, DADLEна продукцию IFN-g в нефракционированной(А) и фракционированной культурах (Б).
Здесь и на рис. 12 число наблюдений n=10. * - р<0,05 к контролю по парному t-критерию Стъюдента.
А


без ФГАФГА 2,5 мкг/мл
Б

без ФГАФГА 2,5 мкг/мл
Рис. 12. Влияние b-эндорфина, DAGO, DADLEна продукцию IL-4 в нефракционированной(А) и фракционированной клеточных культурах (Б).
* - р<0,05 к контролю по парному t-критерию Стъюдента.
При культивировании лейкоцитов в присутствиидиклофенака натриякак стимулирующий, так и угнетающий эффект b-эндорфина на пролиферативный ответ нивелируется, что подтверждает данные о возможном участии простагландинов (простагландина E2 (PGЕ2), в частности) в регуляции функциональной активности лимфоцитов под воздействием опиоидных пептидов. Таким образом, регуляция функциональной активности лимфоцитовb-эндорфином может опосредоваться как системой IL-1, так и простагландинами.
Влияние β-эндорфина и селективных лигандов опиатных рецепторов на процессы клеточной кооперации и переключение Th1/Th2 цитокинового профиля. Следующим этапом исследований являлось изучение роли b-эндорфина в регуляции продукции IL-4 и IFN-g в супернатантах нефракционированной лейкоцитарной взвеси,лимфоцитарной фракции и культуреCD4+ клеток.Как показано на рис. 11, уровень g-IFN в супернатантах под воздействием b-эндорфина, а также в случае комбинации b-эндорфина с налоксоном не отличается от контроля как в нефракционированных культурах, так и в культурах, очищенных от моноцитов, независимо от присутствия ФГА в среде культивирования. Однако в фракционированных клеточных культурах, стимулированных митогеном, регистрируется эффект селективного d-агониста DADLE на продукцию IFN-g,что, очевидно,обусловлено его прямым эффектом на рецепторные структуры клеточнойповерхности лимфоцитов.
На рис. 12 приведены результаты исследования влияния b-эндорфина, DAGO, DADLE на продукцию IL-4 в нефракционированной лейкацитарной суспензии и фракции лимфоцитов.По нашим данным, под воздействием налоксона и DAGO в культурах без митогена регистрируются угнетающий и стимулирующий эффекты соответственно. Выраженный стимулирующий эффект на ФГА-индуцированную продукцию IL-4 оказываютb-эндорфин, налоксон и DADLE.В очищенной фракции лимфоцитов значимых эффектов исследуемые соединения на продукцию IL-4 не выявляется, за исключением угнетающего эффекта

Рис 13. Влияние b-эндорфина 10-7 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
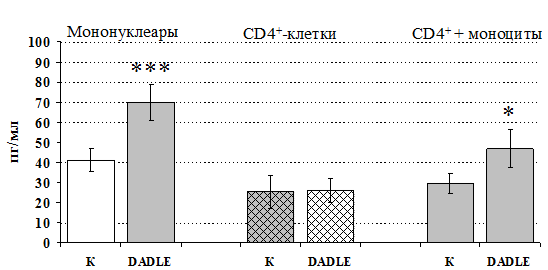
Рис 14. Влияние DADLE 10-7 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
налоксона, зарегистрированного в культурах без добавления митогена.Корреляционный анализ выявил отрицательную зависимость (r=-0,68; р<0,05) между интенсивностью пролиферации и уровнем IL-4 в культурах с совместным внесением b-эндорфина и налоксона в присутствии ФГА. Таким образом, b-эндорфин, налоксон и селективный агонист δ-рецепторов DADLE, усиливая пролиферацию, способствуют изменению соотношения Т-хелперов в сторону Th2-клеток.
Учитывая, что во фракции лимфоцитов находятся Т-, В-лимфоциты, NК-клетки, присутствие которых может оказывать влияние на конечный результат, дальнейшие эксперименты проводились с использованием CD4+-клеток, основных продуцентов IL-4.Как видно из рис. 13, b-эндорфин усиливает продукцию IL-4 во фракции мононуклеаров и не влиет на уровень IL-4в культуре CD4+-клеток. Добавление к CD4+-лимфоцитам моноцитов приводит к восстановлению уровня продукции IL-4 под воздействием b-эндорфина. Аналогичный по силе и направленности эффект на продукцию IL-4 CD4+-лимфоцитами оказывает селективный d-агонист DADLE(рис. 14). Анализвлиянияm-агонистаDAGOвыявилтенденцию

Рис 15. Влияние DAGO 10-8 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
к усилению продукции IL-4 фракцией мононуклеаров (рис. 15), однако статистически достоверного эффекта достичь не удалось. Как видно из рис. 16, внесение b-эндорфина на ФГА-индуцированную продукцию IL-2 мононуклеарами, CD4+-лимфоцитами и комбинацией CD4+-лимфоциты+моноциты влияния не оказывает. Таким образом, полученные данные свидетельствуют о том, чтоот присутствия моноцитов зависит направленность влияния b-эндорфина и d-агониста DADLE на Th1/Th2-поляризацию лимфоцитов. Учитывая важное участие d-рецепторов в регуляции синтеза IL-4 была проанализирована их роль в эффекте b-эндорфина на продукцию данного цитокина. В условиях блокадыd-рецепторов нивелируется усиливающее действие пептида на уровень IL-4 в нефракционированных клеточных культурах. Во фракции лимфоцитов b-эндорфин и налтриндол на продукцию IL-4 не влияют (рис. 17).
Таким образом, результаты проведённых исследований свидетельствуют о важной роли моноцитов в регуляции секреторной активности клеток адаптивного иммунитета, при этомкак агонисты, так и антагонисты опиатных рецепторов оказывают самостоятельные эффекты на активность клеточных популяций.
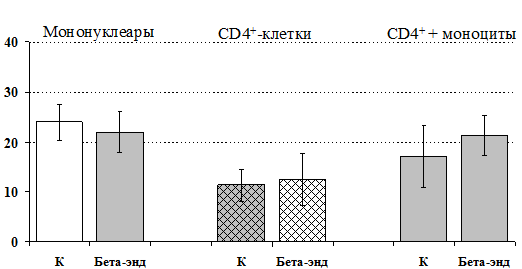
Рис 16. Влияние b-эндорфина 10-7 М на продукцию IL-2 фракцией мононуклеаров, CD4+-лимфоцитами иCD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
АБ


Рис. 17. Эффекты b-эндорфина на фоне блокады d-опиатных рецепторовна продукцию IL-4 в нефракционированной клеточной взвеси (А) и фракции лимфоцитов (Б) в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
Роль b-эндорфина в регуляции фагоцитарной активности клеток естественного звена иммунитета. По нашим данным, β-эндорфин в концентрациях 10-7 и 10-8 М (46,25±1,57 в контроле – 51,3±1,66 - β-эндорфин 10-7 М; P<0,001 к контролю) увеличивает процент фагоцитоза и фагоцитарное число нейтрофилов (0,61±0,02 в контроле - 0,68±0,03 β-эндорфин 10-7 М; P<0,001 к контролю). Помимо нейтрофилов пептид усиливает фагоцитарную активностьмоноцитоввконцентрациях10-7 – 10-8 М,увеличиваяпроцент фагоцитоза (36,9±2,75 в контроле – 47,7±4,8 - β-эндорфин 10-7 М; P<0,05 к контролю)и фагоцитарное число (0,44±0,03 в контроле - 0,67±0,08 β-эндорфин 10-7 М; P<0,05 к контролю). Так же b-эндорфин стимулирует общий (суммарный) фагоцитоз. На фагоцитарную активность эозинофилов β-эндорфин не влияет.
Роль b-эндорфина в регуляции цитокинпродуцирующей функции моноцитов и нейтрофилов.Как видно из табл. 5, 6, ЛПС усиливает продукцию IL-1b, TNF-a, IL-6 только в культурах с фракцией моноцитов, в то время как в культуре лейкоцитов эффект ЛПС на синтез IL-1b, TNF-a, IL-6 отсутствует. В тоже время уровень IL-8 в ответ на ЛПС усиливается в нефракционированной клеточной фракции и не изменяется в очищенной моноцитарной фракции. В нефракционированной клеточной культуре b-эндорфин (10-7-10-11М) активируетLPS-индуцированную продукцию IL-1b, не влияя на синтез IL-6,TNF-a иугнетая продукцию IL-8 в концентрациях 10-7 и 10-11М. b-эндорфин в концентрациях 10-7- 10-11М усиливает продукцию IL-1ra, рецепторного антагониста IL-1b. Значительно менее выраженный стимулирующий эффект пептид оказывает на спонтанную продукцию IL-1b в концентрациях 10-7 и 10-9М. На индуцированную субоптимальной дозой ФГА продукцию исследуемых цитокинов, а так же на их спонтанный и ЛПС-индуцированный синтез в очищенной фракции моноцитовb-эндорфин не влияет.
Данные, представленные на рис. 18 указывают на отсутствие отмены стимулирующего эффекта b-эндорфина на уровень IL-1b в условиях блокады опиатных рецепторов неселективным антагонистом налоксоном (d,m) и селективным d-антагонистом налтриндолом в течение 24 ч культивирования. Также обнаруживается самостоятельный стимулирующий эффект налтриндола на продукцию IL-1b. Выявленная динамика сохраняетсяв течение 48 ч культивирования. Действие b-эндорфина на продукцию антагониста IL-1bIL-1ra (рис. 19) имело картину, схожую с полученной нами при анализе продукции IL-1b. b-эндорфининалтриндол
Таблица 5. Влияние b-эндорфина на продукцию IL-1b, TNF-a, IL-6в нефракционированной лейкоцитарной суспензии
| Цитокин, | Экспериментальное | Концентрация b-эндорфина, M | |||
| пг/мл | воздействие | контроль | 10-7 | 10-9 | 10-11 |
| IL-1b, | Без индуктора | 193,01± | 271,66± | 266,57± | 238,22± |
| n=8 | 39,16 | 77,96* | 49,18* | 50,19 | |
| ЛПС 0,1 мкг/мл | 190,87± | 305,76± | 300,95± | 279,41± | |
| 54,43 | 49,50*** | 76,95** | 62,40* | ||
| TNF-a, | Без индуктора | 253,72± | 286,79± | 277,46± | 290,90± |
| n=8 | 52,60 | 61,43 | 67,08 | 62,32 | |
| ЛПС 0,1 мкг/мл | 269,59± | 297,93± | 295,42± | 295,49± | |
| 53,90 | 66,45 | 68,59 | 60,45 | ||
| IL-6, | Без индуктора | 1115,41± | 1084,09± | 1101,83± | 1109,70± |
| n=8 | 30,54 | 50,23 | 56,55 | 46,66 | |
| ЛПС 0,1 мкг/мл | 1094,73± | 1082,85± | 1051,07± | 1115,41± | |
| 36,40 | 28,72 | 36,16 | 33,88 | ||
| IL-8, | Без индуктора | 1353,68± | 1340,28± | 1664,63± | 1313,30± |
| n=4 | 114,42 | 104,42 | 44,10 | 156,25 | |
| ЛПС 0,1 мкг/мл | 1699,20± | 1278,40± | 1635,43± | 1364,28± | |
| 68,25а | 31,34*** | 68,31 | 59,85** | ||
| IL-1ra, | Без индуктора | 1811,38± | 1840± | 1817,25± | 1932,5± |
| n=4 | 272,30 | 275,54 | 431,75 | 297,55 | |
| ЛПС 0,1 мкг/мл | 1957,13± | 2346,5± | 2168,13± | 2175,13± | |
| 232,16 | 198,97*** | 261,74* | 198,06* |
Примечание. Здесь и в табл. 6:* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Фишера наименьшей значимой разницы, a – р <0,05 – к спонтанной продукции