Первым этапом становления квантовой механики можно считать открытие М.Планком
формулы для плотности теплового излучения (1900 г.) и ее истолкование Эйнштейном на основе
понятия о фотоне (1905 г.), а так же постулаты Бора о состоянии стационарных атомных систем.
Осмысление теории Бора привело к созданию двух вариантов квантовой механики –матричной
механики Гейзенберга (1925 г.) и волновой механики Шредингера (1926 г.). Формулировка
Гейзенберга наиболее подходит к выявлению логической структуры квантовой механики.
Напротив, волновая механика Шредингера удобна для решения прикладных задач.
Развитие вычислительной техники позволило прогнозировать характеристики атомных
систем, не проводя экспериментов.
Состояние каждого электрона в атоме описывают с помощью четырех квантовых чисел:
главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют
движение электрона в пространстве, а четвертое - вокруг собственной оси.
Волнова́я фу́нкция, или пси-функция — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
где — координатный базисный вектор, а — волновая функция в координатном представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятностинахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении.
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь). Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна.
Квантовые числа электронов
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровняот ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3...) и соответствуетномеру периода. Из периодической системы для любого элемента по номеру периода можноопределить число энергетических уровней атома и какой энергетический уровень являетсявнешним.
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимаетзначение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждомузначению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталейс одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l -подуровнем.
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и
принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы
орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении
электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие
противоположным направлениям вращения
| Орбитальное квантовое число | Магнитное квантовое число | Число орбиталей с данным значением l |
| l | ml | 2 l + 1 |
| 0 (s) | ||
| 1 (p) | –1, 0, +1 | |
| 2 (d) | –2, –1, 0, +1, +2 | |
| 3 (f) | –3, –2, –1, 0, +1, +2, +3 |
Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (n = 1,2,3,...). Под главным квантовым числом, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0,1,..., n - 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l 0 1 2 3 4
Буквенное обозначение s p d f g
В этом случае говорят о s-, р-, d-, f-, g-состояниях электронов, или о s-, р-, d-, f-, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т.е. область пространства, в которой наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а такжеорбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное) 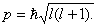 Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественныхфермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения
Принцип наименьшей энергии.
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д. В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
Правило Хунда.
При уменьшении расстояния между электронами энергия их электростатического отталкивания растет. Потому электроны одной оболочки одного атома заполняют такие квантовые состояния, при которых перекрытие их волновых функций, а значит, суммарная энергия взаимодействия, минимальны.
Для этого проекции спинового числа электронов на направление движения должны быть параллельными, а значит, согласно принципу Паули, двухэлектронная волновая функция должна быть антисимметричной относительно перестановок в пространстве. А это, в свою очередь, означает то, что два электрона с параллельными спинами заполняют разные орбитали одной оболочки. При этом, конечно, суммарное спиновое число системы электронов максимально.
Такому состоянию соответствует положительный знак обменной энергии взаимодействия двух электронов. Это значит, что при параллельной ориентации спинов потенциальная энергия взаимодействия электронов уменьшается.
Правило Клечковского
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м годуВ. М. Клечковским и иногда называемого правилом (n + l). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы. Суть его очень проста: орбитальная энергия последовательно повышается по мере увеличения суммы, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа. Например, при орбитальные энергии подчиняются последовательности, так как здесь для -орбитали главное квантовое число наименьшее, для -орбитали; наибольшее, -орбиталь занимает промежуточное положение. Или же: При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа и побочного (орбитального) квантового числа, т.е., имеет меньшее значение.
Энергия ионизации
Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации. В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в кДж/моль, либо эВ.
Энергия ионизации характеризует восстановительную способность элемента. Первая энергия ионизации определяется электронным строением элементов и ее изменение имеет периодический характер. Энергия ионизации возрастает по периоду. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода.
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстояния внешних подоболочек от ядра.
Энергетический эффект присоединения моля электронов к молю нейтральных атомов называется сродством к электрону.
Для характеристики способности атомов в соединениях притягивать к себе электроны введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элементов, эта характеристика имеет условный характер. Однако ее использование полезно для объяснения типа химических связей и свойств соединений.
СРОДСТВО К ЭЛЕКТРОНУ - свойство атомов или молекул образовывать прочную связь с электроном, т. е. отрицательный ион. Характеристикой такой связи является энергия сродства атомов или молекул к электрону - энергия связи электрона в соответствующем отрицат. ионе, к-рая обычно обозначается ЕА (electron affinity). Эта энергия равна разности энергии нейтрального атома (молекулы) восновном состоянии и энергии осн. состояния образовавшегося отрицат. иона. У большинства атомов С. к э. связано с тем, что их внеш. электронные оболочки не заполнены (см. Атом).В табл. приводятся значения энергии С. к э. атомов в осн. состоянии. Осн. и наиб. точная часть этой информации получена при исследовании фотораспада отрицат. ионов. В одном варианте этого метода отрицат. ионы разрушаются под действием лазерного излучения данной длины волны, энергия связи электрона устанавливается по измерениям энергии освободившихся электронов. В др. варианте данного метода для фоторазрушения отрицат. ионов используется излучение перестраиваемого лазера, что позволяет определить положение порога фотораспада отрицат. иона, а по нему и энергию связи электрона. Фотоэлектронный и лазерный методы определения энергии связи электрона в отрицат. ионе являются главными и при исследовании молекулярных отрицат. ионов. В табл. указан класс точности определения энергии С. к э.: О означает точность лучше 0,1%, 1 -лучше 1%; 2 - лучше 3%; 3 - выше 10%; 4 - хуже 10%. Отрицат. ион Не построен на метастабильном атоме Не. «Нет» в табл. означает, что стабильный отрицат. ион данного элемента не образуется.
Электpоoтрицательность χ (греч. хи) — способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру. Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома. Электpоотрицательность атомов, участвующих в образовании химической связи, – один из главных факторов, который определяет не только ТИП, но и СВОЙСТВА этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции. В шкале относительных электроотрицательностей элементов Л. Полинга (составленной на основе энергий связей двухатомных молекул) металлы и элементы-органогены располагаются в следующий ряд:
| Элемент | K | Na | Li | Mg | H | S | C | I | Br | Cl | N | O | F |
| χ | 0.8 | 0.9 | 1.0 | 1.2 | 2.1 | 2.5 | 2.5 | 2.5 | 2.8 | 3.0 | 3.0 | 3.5 | 4.0 |
Элeктроотрицательность элементов подчиняется периодическому закону: она растет слева направо в периодах и снизу вверх в главных подгруппах Периодической системы элементов Д.И. Менделеева.
Электроотрицательность не является а бсолютной константой элемента. Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов, типа атомных орбиталей и характера их гибридизации.
А́ТОМНЫЕ РА́ДИУСЫ, характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом (ион) считается несжимаемым шаром. Используя планетарную модель атома, его представляют как ядро, вокруг которого по орбиталям вращаются электроны. Последовательность элементов в Периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений.
Билет 3.
Скорость хим реакции определяется числом активных столкновений в единицу времени, единицу объема.
Скорость гомогенной хим реакции равна изменению концентрации в-ва реагента за единицу времени при постоянном объеме. V=C/t
Зависит от:природы реагирующих вещ-в, концентрации, температуры, катализатора, степени измельчения твердых веществ.
При повышении температуры на каждые 10град, V возраст в 2-4 раза.
Уравнение Аррениуса: k=A*e^(-Ea/RT), где Еа–энергия активации, R=8.31, е-основание lg.
e^(-Ea/RT) характеризует долю столкновения.
Катализ – изучает скорость хим реакции, при воздействии катализатора.
Катализатор – вещ-ва, которые принимают участие в хим реакции, но после реакции восстанавливаются в том же количественном и качественном составе.
Роль катализатора сводится к: изменению пути реакции, уменьшению времени активации каждой реакции, снижается энергетический барьер, химическое равновесие.
Необратимые реакции, если: выпадает осадок, веделяется газ, образуется слабый электролит, образуются ионы, ядерные реакции.
Химическое равновесие: Vпр=Vобр, отношение равновесных концентратов исходных веществ с учета тахеометрического коэффициента равна константе, энергия Гиббса=0.
Ле-Шателье: если на систему, находящуюся на хим равновесии оказать воздействие, то в системе будут протекать те процессы, которые стремятся свести это воздействие к min.
1) t увел -> эндотермическая; t умен->экзотермическая
2) P увел -> V(n-меньшее к-во); P умен ->V(n-большее к-во)
3) C увел – влево; С умен – вправо.
Билет 4
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление - процесс отдачи электронов, с увеличением степени окисления. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомыокислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные.
1.Составить схему реакции. Mg + H2SO4 → MgSO4 + H2S + …
2.Определить степени окисления элементов в реагентах и продуктах реакции.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + …
3.Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
4.Подчеркнуть элементы, степени, окисления которых изменяются. Mg0 + H2+1 S+6 O4-2 →
Mg+2 S+6O4-2 + H2+1 S-2 + …
5.Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Mg0 → Mg+2 окисляется
S+6 → S-2 восстанавливается
6.В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Mg0 – 2 ē → Mg+2 окисление
S+6 + 8 ē → S-2 восстановление
7.Определить восстановитель и окислитель.
Mg0 – 2 ē → Mg+2 восстановитель
S+6 + 8 ē → S-2 окислитель
8.Сбалансировать число электронов между окислителем и восстановителем.
Mg0 – 2 ē → Mg+2
S+6 + 8 ē → S-2
9. Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
Mg0 – 2 ē → Mg+2 4
S+6 + 8 ē → S-2 1
10.Расставить коэффициенты перед формулами окислителя и восстановителя.4Mg + 5H2SO4 → 4MgSO4 + +H2S + 4H2O
11.Проверить уравнение реакции. Посчитаем количество атомов кислорода справа и слева.
5 * 4 = 20 4 * 4 + 4 = 20